Рауля
Cтраница 4
Рауля, согласно которому зависимость давления паров воды над раствором от концентрации соли линейна. [46]
Рауля здесь недопустимо, поскольку получаемая при этом зависимость Тр ( х) существенно отличается от установленной экспериментально. [47]
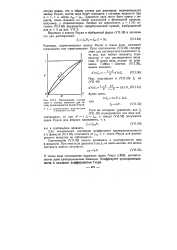 |
Несовпадение состава пара и состава жидкости для систем, подчиняющихся закону Рауля. [48] |
Рауля для растворенного вещества не соблюдается. [49]
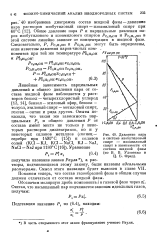 |
Давление пара в системе изобутиловый спирт - изоамиловый спирт в зависимости от состава жидкой фазы ( по В. В. Удовенко и Ц. Б. Фрид. [50] |
Рауля), а растворы, подчиняющиеся этому закону, были названы идеальными растворами. [51]
 |
Давление пара в системе изобутиловый спирт. [52] |
Рауля, то в этом случае принято говорить о положительном отклонении от идеальности. Если же парциальное давление компонента меньше, чем давление, которое следует из закона Рауля, то отклонение от идеальности называют отрицательным. На рис. 42 изображена диаграмма состав - давление насыщенных паров растворов метиловый спирт - бензол при температуре 20 С. Кривая Р соответствует общему ( суммарному) давлению пара, кривые РСНЗОН и PceHe - парциальным давлениям метилового спирта и бензола. Прямые линии представляют общее и парциальные давления пара, полученные по закону Рауля. [53]
Рауля указывают на то, что коллоидные частицы образуются путем ассоциации индивидуальных молекул или ионов мыла. При этом, однако, эти изменения в электропроводности и в осмотических свойствах не соответствуют друг другу по величине, и, например, значения электропроводности оказываются более высокими, чем те значения, которые можно ожидать на основании измерений осмотических свойств. Вскоре после того, как стал известен указанный основной факт различия в величине изменений электропроводности и осмотических свойств, было со всей определенностью доказано, что высокая электропроводность не связана с гидролизом мыла. Все это привело Мак-Бэна к мысли об образовании коллоидных частиц, или мицелл, в результате ассоциации длинноцепочечных анионов жирной кислоты, обладающих большим электрическим зарядом. Эта картина далее была детально разработана и развита, но и сейчас в своей основе она остается неизменной. Свойства анионных и катионных поверхностноактивных веществ, относящихся к группе соединений, называемых коллоидными электролитами, являются во многих отношениях сходными, так же как и свойства других соединений этого типа, как, например, многих красителей и аналогичных солей высокомолекулярных органических кислот или оснований, обладающих поверхностной активностью, присущей обычным молекулярнорастворимым веществам. Помимо заряженных или ионных мицелл в растворах коллоидных электролитов могут находиться мицеллы со сравнительно небольшим зарядом, а в растворах неионогенных поверхностноактивных веществ образуются только незаряженные мицеллы, вследствие чего исследование коллоидных свойств этих соединений является значительно более простым. [54]
Рауля, и можно различать два типа уклонений: положительные и отрицательные. [55]
Рауля указывают на различные явления в них, обусловливающие эти уклонения. Значительные различия во внутренних давлениях и ассоциация молекул жидкости ведут к положительным уклонениям, а тенденция к образованию химич. Сольватация ( см.) состоит в том, что вокруг молекулы растворенного вещества собираются молекулы растворителя более тесно, чем в массе жидкости; такое ску-чивание молекул не имеет резкой границы, а постепенно переходит к обычным условиям в данной жидкости. Сольватация - результат ненормального притяжения между разными молекулами - влечет за собою отрицательные уклонения от закона Рауля. Если в качестве растворителя взята вода, то вместо обшего термина сольватация применяют частный термин - г идр атация. Сольватация и ионизация вместе, особенно если к ним присоединяется различие в химич. Количественный учет наблюдаемых явлений весьма затруднителен из-за сложности явлений; нек-рое облегчение можно получить, вводя вместо упругости пара новые понятия летучести ( Fugacity) и а к-тивности компонентов смеси. [56]
 |
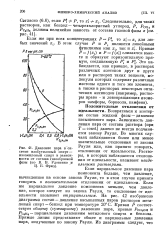
Связь осмотического давления. с давлением насыщенного пара. [57] |
Рауля, из которого следует, что при постоянной температуре относительное понижение давления насыщенного пара растворителя над разбавленным раствором нелетучего вещества независимо от природы растворителя и температуры равно мольной доле растворенного вещества. [58]
Рауля для раствора данной моляльной концентрации; п - число ионов, образуемое одной молекулой электролита. [59]
Рауля и формулируется так: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества. Как видно из ( 2), Ар не зависит от температуры и природы растворенного вещества. [60]
Страницы: 1 2 3 4 5