Реагирование - углерод
Cтраница 1
Реагирование углерода с молекулой НгО должно идти с большей скоростью, чем с СО, вследствие наличия отрицательности со стороны атома кислорода. [1]
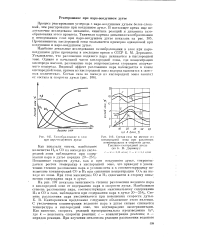 |
Газообразование в слое при парс-воздушном дутье.| Состав газа на выходе из. [2] |
Процесс реагирования углерода с паро-воздушным дутьем более сложный, чем реагирование при воздушном дутье. В настоящее время еще недостаточно исследованы механизм, кинетика реакций и динамика газообразования этого процесса. Протяженность кислородной зоны оказывается примерно одинаковой при воздушном и паро-воздушном дутье. [3]
Механизм реагирования углерода с кислородом представляется следующим образом. Из газового объема кислород адсорбируется на поверхности углерода. На ней атомы кислорода вступают в химическое соединение с углеродом, образуя сложные углеродно-кислородное комплексы СЖОУ. Последние распадаются с образованием СО2 и СО. Скорость распада сильно увеличивается с ростом температуры, практически соответствуя закону Аррениуса. [4]
Первичными продуктами реагирования углерода с кислородом являются CU2 и СО. При повышении температуры выход СО увеличивается. При высоких температурах углерод реагирует с СО2 с образованием СО. Окись углерода, образованная при первичном реагировании, может догорать в газовой среде. [5]
Примем, что реагирование углерода протекает по первому порядку. [6]
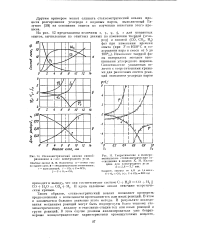 |
Стехиометрический анализ газообразования в слое электродного угля.| Теоретические и экспериментальные стехиометрические соотношения в опытах X. И. Колод-цева для электродного угля d 2 6 - 3 7 мм. [7] |
Другим примером может служить стехиометрический анализ процесса реагирования углерода с водяным паром, выполненный Га-лушко [ 58J на основании опытов по изучению кинетики этого процесса. [8]
Показано [8], что для реакции восстановления СО2 характерно объемное реагирование углерода всех типов. Объемное, или внутреннее, реагирование является основным режимом почти для всех промышленных процессов. Если реакция С О2 в промышленных слоевых аппаратах практически почти всегда протекает в диффузионной области и только на внешней поверхности кусков кокса, то реакция СО2 С почти всегда протекает в кинетической области и связана с внутренним реагированием в порах коксовых кусков. [9]
Имеется обширнейший экспериментальный материал по определению кинетических констант реагирования углерода различных видов топлива с газами. Следует отметить, что этот материал, полученный авторами с применением различных экспериментальных методик на разных видах углеродного материала, отличается большим разнообразием. В табл. 7 - 1 представлены пределы изменения значений энергии активации, полученных в различных исследованиях для реакций взаимодействия углерода с газами. [10]
Аналогичное соотношение продуктов реакции было определено экспериментальным путем в высокотемпературной области реагирования углерода с кислородом в опытах Мейера. [11]
Реакции первая и вторая называются первичными, поскольку они возникают при реагировании углерода с кислородом. [12]
В уравнении ( 16 - 10) первым членом выражено тепловыделение при реагировании углерода до образования СО и СО2 по реакциям ( 16 - 4) и ( 16 - 5) и поглощение тепла при восстановлении COz на поверхности частицы по реакции ( 16 - 6); вторым - отвод тепла от частицы диффузионной теплопроводностью, расходуемой на нагрев кислорода и ССЬ, вступающих в реагирование с углеродом частицы; третьим и четвертым - теплообмен частицы конвекцией с газовой средой и радиацией с облучателем; пятым - расход тепла на нагрев частицы в единицу времени, отнесенный к единице ее поверхности. [13]
При детальном анализе этих реакций выполнили расчеты, необходимые для выйснения области и схем реагирования углерода кокса с активными газами в зонах температур кокса от 600 до 1000 С, при которых возможны реакции, определяющие угар кокса в камерах УСТК. [14]
Это показывает, что переход кислорода из атмосферы через шлак в металл отстает от возможной скорости реагирования углерода и кислорода и поэтому окисленность металла определяется содержанием растворенного в металле углерода. [15]
Страницы: 1 2 3