Реакция - зарождение - цепь
Cтраница 2
В результате реакции зарождения цепи не всегда непосредственно образуются свободные радикалы, участвующие в продолжении цепи. Как правило, однако, один из активных центров цепи появляется раньше другого. [16]
 |
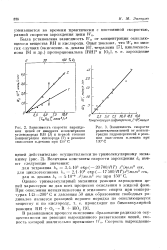
Зависимость lg vlo от обратной температуры в среде кислорода ( /, воздуха ( 2 и азота ( 3 для разных образцов топлива Т-6. [17] |
Кинетические параметры реакции зарождения цепей в топливах РТ, Т-6 и Т-8, измеренные методом ингибиторов [112], приведены в табл. 4.8, а на рис. 4.7 показана зависимость скорости зарождения цепей от температуры для четырех образцов топлива Т-6. В среде азота ( 1 - 2 % О2) скорости инициирования в топливах примерно на порядок ниже чем в среде кислорода, а в среде воздуха примерно в четыре раза меньше чем в среде кислорода. [18]
В результате реакции зарождения цепи не всегда непосредственно образуются свободные радикалы, участвующие в продолжении цепи. В то же время в реакции продолжения цепи принимают участие свободный радикал С2Н5 и атом Н, которые возникают в системе при последующих превращениях СН3 ( см. стр. [19]
Однако тримолекулярный механизм реакции зарождения цепей характерен не для всех процессов окисления в жидкой фазе. [21]
Чрезвычайно низкая скорость реакции зарождения цепи затрудняет измерение ее скорости и изучение детального механизма. [22]
Однозначных доказательств того, что реакция зарождения цепей протекает именно таким образом, не существует. Это объясняется прежде всего тем, что при рассмотрении химических явлений, которым при исследованиях окисления водорода уделялось наибольшее внимание, характер процесса зарождения цепей не играет роли. Существенно только, что его скорость должна быть достаточно мала. [23]
Реакция ( 1) - это реакция зарождения цепи. Скорость ее определяется прочностью свя и С - Н в угле водороде RH, в результате разрыва которой образуется свободный радикал R, продолжающий далее цепь окисления. [24]
В приведенной схеме реакция 1 есть реакция зарождения цепи; реакции 2 и 3 - реакции развития цепи; реакция 4 - реакция обрыва цепи. [25]
Реакция ( 1) представляет собой реакцию зарождения цепи. Скорость ее определяется в конечном счете прочностью С - Н - связи в углеводороде RH, в результате разрыва которой образуется свободный радикал R, продолжающий далее цепь окисления. По данным Н. Н. Семенова [35], прочность С - Н - связи может колебаться для углеводородов с длинной цепочкой от 75 до 95 ккал моль, в зависимости от строения исходного углеводорода. Наиболее прочна связь у парафиновых углеводородов и, в соответствии с этим, окисление парафиновых углеводородов протекает при прочих равных условиях ( температура, катализатор) с меньшими скоростями, чем окисление ненасыщенных или нафтеновых углеводородов. [26]
Согласно цепной теории процессы автоокисления начинаются с реакций зарождения цепи окисления. [27]
Обе схемы отличаются друг от друга только реакцией зарождения цепи. В первом случае цепь зарождается реакцией спонтанного распада перекиси, требующей дошлыю значительной затраты энергии, между тем как во втором случае цепь зарождается реакцией между палентно насыщенными молекулами перекиси боызоила и амина. [28]
 |
Зависимость скорости. [29] |
Эти опыты указывают на роль металлической стенки в реакции зарождения цепей при окислении метилэтилкетона. Инициирование цепей в развившейся реакции осуществляется путем распада на радикалы двух промежуточных продуктов: кето-гидроперекиси и диацетила [73] ( см. гл. Длина цепи при окислении метилэтилкетона падает от 360 звеньев в начале до 12 звеньев в конце реакции. Диацетил и кетогидроперекись в условиях ин-гибированной реакции расходуются нецепным путем. [30]
Страницы: 1 2 3 4