Реакция - ионизация
Cтраница 2
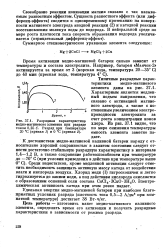 |
Разрядная характеристика. [16] |
Своеобразие реакции ионизации магния связано с так называемым разностным эффектом. Сущность разностного эффекта ( или диф-ференц-эффекта) сводится к одновременному протеканию на поверхности магниевого электрода анодной реакции ( 2) и катодной реакции восстановления молекул воды до водорода. [17]
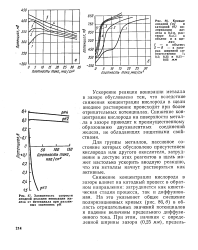 |
Зависимость скорости анодной реакции ионизации железа от потенциала при различных значениях рН. [18] |
Ускорение реакции ионизации металла в зазоре обусловлено тем, что вследствие снижения концентрации кислорода в щели анодное растворение происходит при более отрицательных потенциалах. Снижение концентрации кислорода на поверхности металла в зазоре приводит к преимущественному образованию двухвалентных соединений железа, не обладающих защитными свойствами. [19]
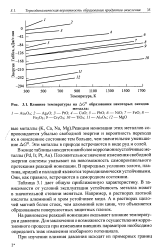 |
Влияние температуры на ДС образования некоторых оксидов. [20] |
На равновесие реакций ионизации оказывает влияние температура и давление. Для заключения о возможности осуществления коррозионного процесса при изменении внешних параметров необходимо определить знак изменения изобарного потенциала. [21]
Согласно (6.9), реакция ионизации жел еза в сульфатном растворе должна протекать по первому порядку относительно ионов сульфата и гидроксила. [22]
Проведенное выше рассмотрение реакций ионизации и диссоциации в неравновесных условиях СВЧ и тлеющего разрядов показало, что существенную роль в формировании коэффициента скорости реакции играет функция распределения по энергиям. Ото обстоятельство обуславливает особую важность знания всей функции распределения, а не только ее высокоэнергетической ( запороговой) части. Поэтому исследование различных типов функций распределения, как экспериментальное, так и теоретическое ( хотя бы приближенное), необходимо для правильного решения задач химической кинетики. Последнее удается провести для функций распределения, определяющих реакции в газовых разрядах. [23]
Расчет констант равновесия реакций ионизации инертных газов в настоящем Справочнике не проводился, поскольку атомы инертных газов имеют высокие потенциалы ионизации. [24]
Пространственные факторы в реакциях ионизации в высшей степени сложны. Однако кажется вероятным, что фактор сжатия других групп кислотным атомом водорода не имеет или очень редко имеет значение. [25]
Стандартный электродный потенциал для реакции ионизации титана с образованием трехвалентных ионов ( что более характерно для активного растворения титана в большинстве условий) равен - 1 21 В. Это значение гораздо более отрицательно, чем потенциалы ионизации таких металлов как железо или цинк, что указывает на большую термодинамическую нестабильность титана по сравнению с этими металлами. Тем не менее, титан коррозионно более стоек, чем железо или цинк. Это зависит в первую очередь от большой склонности титана к пассивации. [26]
Специфическими особенностями обладает и реакция ионизации металла. Так, если в оборотной воде с достаточной высокой концентрацией серной кислоты в процессе разрушения стали образуются растворимые продукты коррозии ( FeSO4), то в воде с нейтральной реакцией основное количество прокорро-дировавшего металла переходит в гидрозакись железа. Последняя не остается на поверхности образцов, как при коррозии в нейтральных средах с кислородной деполяризацией, а распределяется равномерно по всему объему жидкости, и поверхность металла после опытов приобретает травленый вид. [27]
Выход по току для реакции ионизации алюминия, магния и бериллия в расчете на устойчивые в растворах валентности ионов этих металлов ( А13, Mg2, Be2) значительно превышает 100 %, причем это превышение зависит от природы электролита. Видимо, переход этих металлов из металлической решетки в раствор происходит частично в виде катионов низшей валентности. [28]
Показано, что скорость реакции ионизации кислорода на никеле и серебре существенно зависит от состояния поверхности электродов, от наличия фазовых окислов и от присутствия хемосорбированного кислорода. На композициях никель - серебро скорость этой реакции определяется состоянием поверхности, причем скорость реакции значительно возрастает при окислении поверхности. [29]
СР - константа равновесия реакции ионизации атома урана; / С - постоянная Больцмана; Т и Р - абсолютная температура и давление плазмы. [30]
Страницы: 1 2 3 4