Реакция - карбанион
Cтраница 2
Нами разработаны теоретические основы применения метода нук-леофильного ароматического замещения водорода для синтеза азотсодержащих гетероциклических структур на основе реакции карбанионов арил-ацетонитрилов с нитроаренами. [16]
Приведенные выше примеры свидетельствуют о том, что, хотя бензоиновая конденсация и родственные реакции находили ограниченное синтетическое применение в течение целого столетия, сейчас их следует рассматривать как один общий класс реакций замаскированных ацильных карбанионов. [17]
Однако более важным является вывод о том, что реакции, протекающие с участием а-сульфшшльных карбанионов, могут обнаруживать значительную сгереоселективность при дейтеро-водо-родном обмене, а также при необратимом удалении одного из двух диастереотопных протонов под действием алкиллития [123] или при образовании диастереомерных продуктов реакции карбанионов с электрофпламп. [18]
В качестве катализаторов в этих реакциях используют органические основания. Интересным примером является реакция карбанионов ( 108), полученных из эфиров 1 4-бутандиовой ( янтарной) кислоты, например ( CH2CO2Et) 2, с альдегидами или кетонамй с применением алкокси-ионов в качестве основных катализаторов - конденсация Штоббе. Эти эфиры реагируют намного легче, чем можно было бы ожидать, причем в ходе реакции одна из групп CO2R превращается в СО2 - Продуктом реакции является а р-ненасыщенное производное ( ПО); альдоль не образуется. [19]
О и - N - О, способны ускорять реакции, катализируемые основаниями. Это позволяет исследовать реакции карбанионов весьма слабых кислот, например олефиновых углеводородов, при низких температурах. Поскольку применение диполярных растворителей в органических реакциях подробно изложено в литературе [ 155, 1561, здесь этот вопрос не рассматривается. Рассматриваются лишь реакции и свойства карбанионов, представляющие непосредственный интерес для нефтеперерабатывающей и нефтехимической промышленности - окисление, изомеризация и элиминирование. [20]
Этилбензол имеет большую скорость реакции, чем толуол, хотя он металлируется в меньшей степени. Это объясняется повышенной скоростью реакции менее стабильного карбаниона с этиленом, как уже указывалось при рассмотрении n - диалкилбензолов. Когда заместителями являются высшие алкилы, как в случае srop - бутилбензола, наблюдается сравнительно низкая скорость. Это может быть обусловлено значительным снижением степени металлирования в таком соединении, а также дополнительным влиянием стериче-ских факторов, если последние имеют здесь место. [21]
Лри обработке сульфонийилидов карбонильными соединениями реакция Виттига [62], характерная для илидов фосфора, не протекает. В этом случае аналогично реакциям сульфинилсодержащих карбанионов [63] образуются эпоксисоединения. [22]
Альтернативным синтезу, в котором атом серы нуклеофилен, является синтез, в котором сера связана с уходящей группой. В принципе к образованию тиоэфиров должна приводить реакция карбаниона с сульфенилгалогенидом. [23]
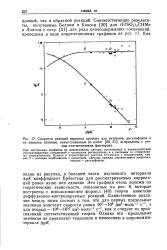 |
Скорости реакций переноса протона для нитрилов, дисульфонов и их анионов ( данные, заимствованные из работ, исправлены с учетом статистических факторов. [24] |
При построении графиков не использованы данные, относящиеся к взаимодействию рассматриваемых соединений с частицами растворителя и к системам со стерически-ми затруднениями. Кривая а характеризует реакции СН-кислот с основаниями; кривая б - реакции карбанионов с кислотами. [25]
Не было приведено специальных доказательств этой структуры, и представляется более вероятным, что этому соединению отвечает строение вторичного спирта XI, поскольку следовало бы ожидать, что карбанион будет атаковать первичный углеродный атом окиси стирола. Недавно Томоскози [21] показал, что, как и в случае фосфониевого илида, реакция фос-финоксидного карбаниона с оптически активной а-окисью стирола сопровождается обращением конфигурации у асимметрического атома углерода. [26]
Уитлок [35] получил циклический диен реакцией о-ксилилен - б с-диэтилфосфоната с а-дикетоном. Михальский и Музиро-вич [27] нашли, что соединение XVI также образует карбанион в присутствии грет-бутилата калия; реакция карбаниона с карбонильными соединениями тоже приводит к олефинам. [27]
Среди различных химических превращений ацетиленовых соединений важное место занимают реакции, протекающие с сохранением СС-связи. Они обычно основаны на депротони-ровании ацетилена или его гомологов, содержащих подвижный атом водорода, и рассматриваются как реакции карбанионов. [28]
Этот механизм был доказан проведением отщепления в C2H5OD как растворителе и прекращением реакции до ее завершения. Не вступивший в реакцию ( 3-изомер содержит в этих условиях дейтерий ( CeH6DCI6), что нельзя объяснить иначе, как реакцией карбаниона с тяжелым спиртом, так как первая стадия реакции обратима ( С. [29]
Карбоксильная группа может быть введена двумя путями. Первый путь состоит в применении моноксида углерода в присутствии катализатора, чаще всего металлорганического соединения. Второй путь использует реакцию карбаниона с диоксидом углерода. Оба эти метода мы рассмотрим раздельно. [30]
Страницы: 1 2 3