Реакция - кислород
Cтраница 1
Реакции кислорода с некоторыми органическими жидкостями имеют нулевой порядок по О2, так как лимитирующей стадией здесь является образование свободных радикалов без участия кислорода. Последний обсуждает механизмы многих реакций окисления. [1]
Реакции кислорода с ниобием делят на две группы: а) растворение О2 в решетке Nb и образование субокисных фаз при выдерживании металла в атмосфере кислорода при различных температуре и давлении; б) образование нескольких окислов, в которых металл находится в различной степени окисления. [2]
Реакции кислорода в кремнии представляют значительный интерес, так как раскрывают подробности процессов, которые, возможно, имеют место при молекулярном осаждении, в частности процессов, которые приводят к образованию стабильных центров. [3]
Реакции кислорода с ниобием и танталом можно разделить на две группы: а) растворение кислорода в решетке металла и образование субокисных фаз при выдерживании металла в атмосфере кислорода при различных температурах и давлениях; б) образование нескольких гомогенных кристаллических окисей, в которых металл находится в различных состояниях окисления. [4]
Реакции кислорода с углеродом, обычно присутствующим в накаленном вольфрамовом катоде, приводят к образованию СО и СО2 - Наличие атомарного водорода в манометрическом преобразователе приводит к образованию Н2О, СН4 и СО. [5]
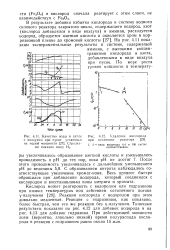 |
Качество воды в петле с воздухом при пуске установки на малой мощности. Стрелками показан ввод Ш.| Удаление кислорода при остановке реактора. [6] |
Реакция кислорода с водородом при этом довольно медленная. Реакция с гидразином, как показано, более быстрая, чем эта же реакция без у-излучения. Типичные результаты показаны на рис. 4.12 для добавок водорода и на рис. 4.13 для добавок гидразина. При действующей мощности дозы ( вероятно, довольно низкой) время полураспада кислорода в реакции с гидразином равно около 15 мин. [7]
Реакция кислорода с углеродом характеризуется образованием обоих окислов углерода - СО и С02, но соотношение между ними оказывается весьма различным в разных условиях опыта и для разных типов углерода. [8]
Реакция кислорода со стпролышми свободными радикалами ( стадия 2), вероятно, очень быстрая и приводит к образованию малоактивного иерекис-ного свободного радикала R-О - О - , который крайне медленно реагирует с мономерным стиролом. На ото указывает тот факт, что нормальная полимеризация полностью подавляется кислородом при энергичном перемешивании. Реакция перекисного радикала с молекулой стирола ( стадия 3), очевидно, более медленная, чем реакция стирольного свободного радикала с молекулой стирола, так как общая скорость образования полимерной перекиси составляет только около 0 1 % скорости нормальной полимеризации. Тем не менее реакция ( 3) значительно более быстрая, чем реакция ( 1), которая определяет скорость процесса. [9]
Реакция кислорода с углеродом характеризуется образованием обоих окислов углерода - СО и С0г, но соотношение между ними оказывается весьма различным в разных условиях опыта и для разных типов углерода. [10]
Эти реакции кислорода происходят спонтанно только при условии, что реагирующие вещества нагреты до температуры, близкой к их температуре воспламенения. Когда горение началось, выделяется достаточно тепла, чтобы воспламенить негорящие участки. Чтобы погасить огонь, необходимо просто охладить ( водой) материал ниже его температуры воспламенения или же прекратить доступ кислорода. [11]
Некоторые реакции кислорода называют сгоранием, так как они сопровождаются выделением тепла и света. Отметим, что так называются не все реакции, в процессе которых образуются эти формы энергии. [12]
Хотя реакция кислорода с графитом энергетически выгодна, графит тем не менее существует, поскольку эта реакция протекает очень медленно кинетически. Многие природные соединения находятся вне равновесия с их окружающей средой и вступают в реакции крайне медленно. В холодных условиях ( низкая энергия) лишь у небольшого числа молекул А и В случайно окажется энергия, достаточная для преодоления энергии активации, но это редкое явление, и реакция будет протекать медленно. Если повысить энергию реагентов ( например, повысив температуру), реакция сможет протекать быстрее, поскольку большее число молекул А и В будут иметь требуемую энергию активации. [13]
В реакции кислорода с полимерными органическими соединениями образуются летучие продукты превращения - альдегиды, кетоны, кислоты и др., что обусловливает легкое их удаление с поверхности окисляющегося твердого вещества, и тем самым сильно облегчается доступ кислорода к поверхностному слою молекул исходного соединения. В случае же окисления полимерных кремпийорганыческнх соединении кислородом происходит разрыв относительно слабых Si-С - связей и сшивка образовавшихся при этом радикалов через силоксанные связи, атака которых окислителем малоэффективна. Таким образом, окисление, затрагивающее Si-С - связь в кремнийорганических полимерных соединениях сопровождается отщеплением органических радикалов в виде окисленных продуктов, но сами цепи, состоящие в большинстве случаев из силоксаиных звеньев, при этом не разрушаются. Это, в свою очередь, приводит к образованию поверхностного слоя, обладающего высокой концентрацией силоксанных звеньев, и тем самым затрудняющего диффузию через него кислорода, что обусловливает его защитное действие в реакции окисления. [14]
Скорость реакции кислорода с борорганическими соединениями весьма сильно различается в зависимости от их природы. Количественных кинетических закономерностей для таких реакций не установлено до настоящего времени, однако наблюдения качественного характера имеются. [15]
Страницы: 1 2 3 4