Реакция - крекинг - углеводород
Cтраница 3
Сульфиды и оксиды молибдена и вольфрама с промоторами являются бифункциональными катализаторами ( с п - и р-проводимостями): они активны как в реакциях гидрирования-дегидрирования ( гемолитических), так и в гетеролитических реакциях гидрогенолиза гетеро-атомных углеводородов нефтяного сырья. Однако каталитическая активность Мо и W, обусловливаемая их дырочной проводимостью, недостаточна для разрыва углерод-углеродных связей. Поэтому для осуществления реакций крекинга углеводородов необходимо наличие кислотного компонента. [31]
Сульфиды и оксиды молибдена и вольфрама с промоторами являются бифункциональными катализаторами ( с п - и р-проводимостями): они активны как в реакциях гидрирования-дегидрирования ( гемолитических), так и в гетеролитических реакциях гидрогенолиза гетеро-атомных углеводородов нефтяного сырья. Однако каталитическая активность Мо и W, обусловливаемая их дырочной проводимостью, недостаточна для разрыва углерод-углеродных связей. Поэтому для осуществления реакций крекинга углеводородов необходимо наличие кислотного компонента. Следовательно, катализаторы процессов гидрокрекинга являются по существу минимум трифункциональными, а селективного гидрокрекинга - тетрафункциональными, если учесть их молскулярно-ситовые свойства. Кроме того, когда кислотный компонент в катализаторах гидрокрекинга представлен цеолитсодержа-щим алюмосиликатом, следует учесть также специфические крекирующие свойства составляющих кислотного компонента. Так, на алюмосиликате - крупнопористом носителе - в основном проходят реакции первичного неглубокого крекинга высокомолекулярных углеводородов сырья, в то время как на цеолите - реакции последующего более глубокого крекинга - с изомеризацией среднемолекулярных углеводородов. [32]
Согласно этой теории вещества, электронно-возбужденные молекулы которых способны при ударах второго рода колебательно возбудить реагирующие молекулы, ускоряют химические реакции в разрядах. Такие вещества были названы энергетическими катализаторами. Активирующее действие добавок паров ртути, например, было установлено в реакциях крекинга углеводородов [136], а также при синтезе [79] и разложении [78] аммиака в тлеющем разряде. [33]
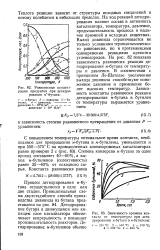 |
Равновесные концентрации продуктов при дегидрировании - бутана.| Зависимость времени контакта от температуры при дегидрировании н-бутана в я-бутилены. [34] |
Теплота реакции зависит от структуры исходных соединений и потому колеблется в небольших пределах. На ход реакций дегидрирования влияют состав и активность катализатора, температура, давление, продолжительность процесса и наличие примесей в исходных веществах. Выход дивинила ограничивается не только условиями термодинамического равновесия, но и протекающими одновременно реакциями крекинга углеводородов. На рис. 82 показана зависимость равновесия реакции дегидрирования н-бутана от температуры и давления. В соответствии с принципом Ле-Шателье увеличению выхода дивинила способствуют пониженное давление и применение более высоких температур. [35]
Реакции протекают при температурах 550 - 600 С. Предполагается, что механизм процесса включает депрото-нирование аллильного атома углерода с образованием карбаниона и последующее отщепление гидрид-иона. По-видимому, реакция крекинга углеводородов не характерна для основных катализаторов, на которых процесс осуществляется через промежуточный карбанион. [36]
Для дифенила величина энергии активации не могла быть вычислена за недостатком данных. По аналогии с нафталином, впредь до получения новых экспериментальных данных, мы условно принимаем ее равной 90 000 кал / молъ. Антрацен, как это видно будет в дальнейшем, стоит особняком среди изученных углеводородов. Поэтому в настоящее время трудно даже ориентировочно предсказать величину энергии активации реакции крекинга указанного углеводорода, не рискуя впасть в большую ошибку. Можно только полагать, что величина энергии активации реакции крекинга антрацена значительно ниже, чем для: остальных ароматических углеводородов. [37]
К сожалению, ни один из этих методов испытания не позволяет сделать сколько-нибудь общего вывода о поведении рассматриваемого катализатора. Поэтому катализатор необходимо испытывать в каждой реакции, в которой намечают его использовать. Даже в реакциях одного и того же типа, например в реакциях крекинга углеводородов, существует несколько методов определения активности. [38]
В этом же разделе мы рассмотрим каталитические свойства и структуру карбидов и боридов Ni и Со. Рентгенографическое исследование показало, что в процессе работы катализатора в нем накапливается углерод и появляется металлический никель. Не исключено, что под влиянием каталитической реакции происходит существенная перестройка решетки карбида никеля. Во всяком случае, если вести реакцию крекинга в присутствии Н2, то единственной фазой в работавшем катализаторе становится металлический никель. Поэтому предполагается, что карбид никеля, возможно, не является промежуточным соединением, образующимся при проведении реакции крекинга углеводородов на никеле. [39]
Очевидно, что, если структурная ячейка алюминия находится на поверхности, ее строение будет иным, чем в объеме, так как поверхностный алюминий не может быть окружен четырьмя группами - О-Si. Вместе с тем в первичных частицах геля, размер которых не превышает нескольких нанометров, значительная доля атомов остается на поверхности. Многочисленные данные свидетельствуют, что в зависимости от условий эксперимента алюмосиликаты проявляют или бренстедовские, или льюисовские кислотные свойства. Количество бренстедовских центров уменьшается при обмене на ионы щелочных металлов и растет с увеличением степени гидратации; в том же направлении изменяется каталитическая активность геля в реакции крекинга углеводородов. [40]
При несколько более высоких температурах свечение имеет вид бледно-голубого пламени, которое обычно медленно распространяется от центра сосуда. Иногда несколько таких голубых пламен, или холодных пламен, как их часто называют, следуют друг за другом с интервалами несколько секунд. При еще более высокой температуре холодные пламена заменяются более интенсивным свечением в виде голубого или желтого пламени ( в зависимости от температуры и состава), которое приводит к взрыву. Для многих углеводородов изучены области воспламенения. Сложность реакций окисления углеводородов может быть частично объяснена тем фактом, что свободные радикалы могут катализировать реакции крекинга углеводородов. С ростом температуры и удлинением углеродного скелета значение реакций пиролиза увеличивается, так как с увеличением размера углеводородных радикалов растет скорость их распада. [42]
Страницы: 1 2 3
