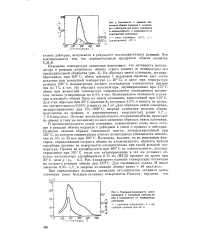
Реакция - обмен - водород
Cтраница 2
В 1952 г. Хенсфорд и другие [4] изучали реакции обмена водорода между тяжелой водой и углеводородами на алюмосиликатном катализаторе и установили, что олефины вступают в обмен при наиболее низких температурах, парафиновые углеводороды с третичным углеродным атомом и бензол - при средних, а парафины с первичным и вторичным углеродным атомами - при более высоких температурах. [16]
В противоположность окиси алюминия, алюмосиликат очень мало активен в реакции обмена водорода с дейтерием в смеси к-пропана и дейтерия. Наиболее активен образец смешанного окисла, дегидратированный при 52 5 С, на котором концентрация легкого углеводорода уменьшается меньше, чем на 3 % за 50 мин при 400 С. Возможно, важным, но не решающим фактором, определяющим скорость обмена на алюмосиликате, является низкая адсорбция пропана на поверхности алюмосиликата при такой высокой температуре. Пропан не адсорбируется при 400 С на алюмосиликате, дегидратированном при 505 С, тогда как активированные в тех же условиях образцы катализатора адсорбировали 6 74 мл ( НТ. Для смешанного окисла М имеет значение 0 93 - 1 1, и энергия активации обмена равна - 16 ккал / молъ. [18]
Рассмотренные данные позволяют сделать вывод, что каталитическая активность окислов в отношении реакции обмена водорода с дейтерием определяется в первую очередь электронной конфигурацией металлического иона, причем условием высокой активности является наличие у этого иона некоторого, но не слишком большого числа неспаренных d - электронов. Однако интерпретация этого условия в приложении к механизму обмена оказывается нелегкой задачей, особенно вследствие недостаточности данных о реакционноспособной хемо-сорбции водорода на окислах. Тем не менее соображения, приводимые ниже, могут дать некоторые представления о влиянии электронного фактора. [19]
Существенную роль в дальнейшем развитии работ по изотопному обмену водорода сыграла классификация реакций обмена водорода, разработанная А. И. Бродским на основе рассмотренных выше представлений. [20]
Со времени проведения наших работ накопилось много фактов, указывающих на низкие энергии активации реакций обмена водорода и дейтерия и пара-орто-превращения; однако механизм этих процессов и теперь остается недостаточно выясненным. [21]
Изучен механизм трех каталитических реакций на металлическом палладии в интервале температур 150 - 300: реакция обмена водорода с дейтерием, реакция окисления водорода и реакция гидрирования этилена. Во всех трех случаях механизм реакции радикальный. [22]
Аналогично реакциям рекомбинации ионов при возбуждении карбоновых кислот [9] протонирование возбужденных молекул ароматических углеводородов при реакции фотохимического обмена водорода должно приводить к уменьшению ( тушению) флуоресценции углеводорода и к появлению флуоресценции карбониевого иона. Тщательное изучение спектров флуоресценции ароматических углеводородов в кислых растворах показало, что действительно квантовый выход флуоресценции углеводородов уменьшается от функции кислотности. [23]
Замедление обменной реакции, катализируемой кислотой при положительном заряде субстрата, подтверждено экспериментально сравнением скоростей реакций обмена водорода в ароматических углеводородах. [24]
Замедление обменной реакции, катализируемой кислотой при положительном заряде субстрата было подтверждено экспериментально путем сравнения скоростей реакций обмена водорода в ароматических углеводородах. [25]
Parravano, University of Notre Dame): При сравнении каталитической активности окислов металлов в отношении реакции обмена водорода с дейтерием ( статья 9) возникает трудность при попытке получить сходные окислительно-восстановительные состояния поверхностей различных окислов. Так, например, хорошо известно, что окись цинка может быть совершенно неактивной в интервале 200 - 300 или активной при снижении температуры до - 70 [2] в зависимости от предварительной обработки. Одинаковая предварительная обработка может и не привести к аналогичному окислительно-восстановительному состоянию различных окислов. [26]
В нашей работе, выполненной совместно с С. Э. Вайсбергом [ 2J, было показано, что в случае реакций обмена водорода на дейтерий заметные отличия величины а от единицы являются правилом, но не исключением. [27]
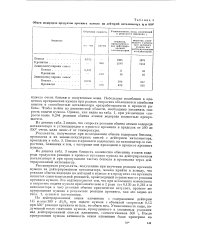 |
Обмен водородов продуктов крекинга кумола на дейтерий катализатора щ и 450. [28] |
Рассматривая результаты, полученные при изучении реакции крекинга кумола на дейтерированном катализаторе, можно прийти к выводу, что реакция обмена водорода на дейтерий в кумоле и в продуктах его крекинга является самостоятельной реакцией, происходящей независимо от реакции крекинга кумола. Это подтверждается тем, что при небольших изменениях в скоростях подачи кумола приблизительно в 2 раза ( от 0 130 до 0 264 л / л катализатора и час) реакция обмена практически затухает, процент же превращения кумола в результате реакции крекинга, как это видно из табл. 1, остается постоянным. [29]
Целью настоящего исследования было выяснение вопроса о том, существует ли зависимость между активностью различных образцов окиси алюминия и алюмосиликатов в реакции обмена водорода на дейтерий в w - про-пане и активностью их в реакции переноса электрона или кислотностью их поверхности. Сообщаются также результаты измерений величины поверхности катализаторов и адсорбции пропана на них. [30]
Страницы: 1 2 3 4