Реакция - обмен - водород
Cтраница 3
Риттенберг [18] сообщил, что ряд сульфидов металлов, в том числе MoS2, WS2 и CoS ( но не FeS, CuS, Cu2S или NiS), являются активными катализаторами для реакций обмена водорода. [31]
Реакция эта бимолекулярна, сумма стехиометрических коэффициентов равна двум, и реакция должна была бы идти по второму порядку. Реакция обмена водорода с дейтерием идет в несколько стадий. [32]
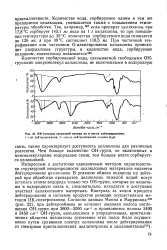 |
ИК-Спектры вискозной пленки до и после дейтерирования. [33] |
Интересным и достаточно однозначным методом характеристики структурной неоднородности целлюлозных материалов является дейтерирование целлюлозы. В реакцию обмена водорода на дейтерий при обработке препаратов целлюлозы тяжелой водой могут вступать атомы водорода только тех ОН-групп, которые не включены в водородную связь и, следовательно, находятся в доступных участках целлюлозного материала. [34]
Молекулярный водород, по-видимому, не вступает в реакцию переноса. Это было подтверждено изучением реакции обмена водорода с применением дейтерия. [35]
В большинстве случаев при увлажнении и последующем высушивании целлюлоза подвергается структурным изменениям. Поэтому можно было ожидать, что в реакциях обмена водорода ОН-групп на дейтерий и тритий, которые всегда сопровождаются увлажнением и последующей сушкой целлюлозы, также будут наблюдаться изменения структуры. Количественные измерения показали, что устойчивые OD-группы возникали частично в результате увеличения степени кристалличности на 3 1 %, которое происходило при увлажнении и высушивании. [36]
Полупроводниковые характеристики окиси цинка изучены относительно хорошо. Поэтому мы рассмотрим прежде всего ее свойства как гидрогенизационного катализатора реакции обмена водорода с дейтерием. Скорость последней реакции является, по существу, мерой скорости обратимой хемосорбции водорода в равновесных условиях; поэтому ниже будут приведены также данные по хемосорбции водорода. Любая теория хемосорбции водорода на окиси цинка должна объяснить следующие хорошо установленные факты. [37]
Узкие поры ( средний размер - 4 А) имеются в окиси алюминия, полученной прокаливанием гиббсита при 450 С; с ростом температуры прокаливания они расширяются, и для образца, полученного при 580 С, средний размер узких пор составляет уже - 22 А; при прокаливании при 750 С эти узкие поры исчезают совсем. Однако измерения, осуществленные в настоящей работе, ясно показали, что реакция обмена водорода с дейтерием - простой ступенчатый процесс для всех активных окисей алюминия, независимо от температуры дегидратации. Если размер пор является важным фактором для реакции обмена, то следует ожидать, что на образцах окиси алюминия, активированных при низкой или высокой температуре, реакция контролируется диффузией. [38]
Стадией, фактически изучаемой при этой реакции, является отнятие метильных атомов водорода атомами хлора. По-видимому можно считать, что процесс соединения образующихся бензильных радикалов с атомами хлора не осложнен реакциями обмена водорода, и поэтому изотопный состав непрореагировавших веществ - хлористого бензила и хлористого водорода, будет характерным для первичной реакции отнятия водорода. [39]
Однако если образцы облучить источником у-радиации, то электронное возбуждение может достигнуть стадии свободного радикала, фиксируемого в виде спектра ЭПР, каталитическая активность при этом резко возрастает, что является доказательством в пользу изложенных представлений об электронодоиорцом и электроноакценторном характере активных центров. Они отражены и во всесторонних исследованиях доктора Пинка с сотрудниками, установившими связь между активностью в реакции обмена водорода на дейтерий в пропане и активностью в переносе электрона ( или кислотностью поверхности) ряда окисей алюминия и алюмосиликатов. [40]
Это означает, что при внутридиффузионной кинетике реакция обмена, например, лития на водород протекает значительно быстрее, чем реакция обмена водорода на литий. [41]
Приближенный расчет показывает, что для насыщения поверхности окиси алюминия величиной 300 - м7 - / г необходимо 6 - 7 вес. В результате удаления этих гидроксиль-ных ионов ( в виде воды) благодаря высокотемпературной сушке поверхность окиси алюминия остается в модифицированном состоянии с высокой энергией. Можно предположить, что образованные таким образом модифицированные места и являются активными центрами для реакций обмена водорода с дейтерием и гидрогенизации этилена. [42]
На комплексе полинафтохинона с акцептором электронов, РеС13, идут иные процессы: адсорбция этилового спирта, которая происходит очень быстро с выделением 3 6 - 10 Дж / моль, что соответствует энергии двух водородных связей, затем дегидратация спирта с образованием эфира. Этот комплекс катализирует реакцию обмена Н2 i2 D2 при 78 С, а синтез аммиака из водорода и азота идет при 300 С даже в присутствии кислорода. Комплекс полинафтохинона с РеС13 в реакции Н2 2 D; малоактивен. В присутствии FeClj гидрирование пропилена ускоряется, а реакция обмена водорода на дейтерий замедляется по сравнению с комплексом полинафтохинона с калием. По данным Jchikawa [77, 78], реакции гидрирования непредельных соединений катализируют также комплексы ароматических углеводородов со щелочными металлами. [43]
 |
Хроматограмма смеси эфиров N-трифторацетил аминокислот ( R или S и /. - 2-бутанола. [44] |
Когда нужно получить соединение с высоким содержанием дейтерия, методику повторяют несколько раз, чтобы уменьшить влияние разбавления дейтериевого источника протонами соединения, которое метят. Это довольно утомительная процедура, так как необходимы большие предосторожности во избежание загрязнения D20 атмосферной ШО. Если в газо-жидкостной хроматографии твердый носитель пропитать смесью жидкой фазы с гидроксидом натрия, а затем обработать несколькими большими порциями D2O ( 100 мкл), вводя их в колонку, то атомы водорода, способные обмениваться, заменятся на атомы дейтерия. Далее, если ввести кетон, NaiOD в колонке будет катализировать реакцию обмена водорода в кетоне на дейтерий. [45]
Страницы: 1 2 3 4