Реакция - двойной обмен
Cтраница 1
Реакции двойного обмена в обычном смысле слова, по нашим современным представлениям о реакциях электролитов, вовсе не существуют. [1]
Реакции двойного обмена позволяют получать многие золи труднорастворимых соединений. Например, при смешивании разбавленных растворов нитрата бария и сульфата калия при условии избытка одного из реагентов сульфат бария не выпадает в осадок, а образует коллоидный раствор. [2]
Реакция двойного обмена служит для получения золей кремневой, оловянной и вольфрамовой кислот. [3]
Реакция двойного обмена между сульфидом натрия и карбонатом кальция была изучена методом дифференциального термического анализа: при 170 С гидроокись натрия, обычно присутствующая в сульфиде натрия, вступает в реакцию с карбонатом кальция; при 520 С гидроокись кальция теряет содержащуюся в ней воду, а при 670 С начинается реакция двойного обмена. Диаграмма фазовых состояний двукомпонент-ной системы сульфид натрия - карбонат натрия имеет эвтектику. [4]
Реакции двойного обмена АВ CD АС - - BD и некоторые более сложные реакции. В эту таблицу, наряду с реакциями двойного обмена, для которых характерно постоянство числа молекул до и после реакции, включены также две реакции ( реакции NOC1 и N02), приводящие к увеличению числа молекул. [5]
Реакцией двойного обмена из KjMn ( CN) e ] - 3H20 были получены трудно растворимые, окрашенные в различные цвета ацидо-соединения: Zn2 [ Mn ( CN) 6 ] - фиолетовое, Cd2 [ Mn ( CN) 6 ] - фиолетовое, Co2 [ Mn ( CN) 0 ] - красновато-коричневое, Cu2 [ Mn ( GN) 6 ] - желтое, Pb2 [ Mn ( CN) 6 ] - желтое, Ca2 [ Mn ( CN) 6 ] - синее, Ba2 [ Mn ( CN) 6l - синее, Al4 [ Mn ( CN) 6 ] 3 - синее. [6]
По реакции двойного обмена между растворами гексамминкобальт - ( III) хлорида и гексароданородиатом ( III) калия получается комплексная соль состава [ Co ( NH3) e ] [ Rh ( SCN) 6 ] - 3H2O в виде кристаллического оранжево-красного осадка. [7]
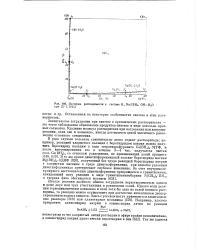 |
Изотерма растворимости в системе К, Na ВШ, ОН-Н20. [8] |
Иногда реакция двойного обмена затруднена нерастворимостью одного и даже двух или трех участвующих в равновесии солей. Однако если реакция термодинамически возможна и если хотя бы одна из солей немного растворима, то реакцию можно осуществить при достаточно интенсивном диспергировании исходных веществ. [9]
 |
Схема короткозам-кнутых локальных элементов в применении к реакции двойного обмена AgCl iNaiIAg. l NaCl в порошкообразных смесях. [10] |
Механизм реакции двойного обмена с образованием газообразного продукта во многих случаях остается невыясненным. [11]
Проведение реакций двойного обмена на ионитах тогда, когда одно из образующихся соединений труднорастворимое, также имеет важные преимущества перед обычным осаждением, применяемым в подобных случаях. [12]
Применению реакций двойного обмена, например реакции органических галогенидов или сульфатов с неорганическими цианатами, препятствуют плохие выходы и трудности выделения продуктов реакции. [13]
Среди реакций двойного обмена имеется большое число таких, которые по определенным общим признакам можно характеризовать как реакции нейтрализации. [14]
Помимо реакций двойного обмена, запатентованы также другие способы дальнейшей переработки хлористых алкилов, получаемых прямым хлорированием. [15]
Страницы: 1 2 3 4