Реакция - окисление - железо
Cтраница 1
Реакция окисления железа водой имеет ряд особенностей, делающих ее удобным объектом исследования. Реакция протекает в отсутствии кислорода практически без образования побочных продуктов. [1]
Удельные скорости реакции окисления железа водой, как указывалось, составляют 10 - п моль / ( см2 - с), диаметр пор железа - около 1000 А, размеры зерен железа - около 0 2 см. Для реакции дегидратации этилового спирта на ос-окиси алюминия значения удельной скорости реакции близки к приведенным, средний радиус пор - около 200 А, размеры зерен - около 0 5 см. При этом дегидратация этилового спирта протекала в кинетической области и для перехода во внутридиффузионную-область потребовалось увеличение удельной скорости реакции на два порядка при одновременном уменьшении среднего радиуса пор до 60 А. [2]
 |
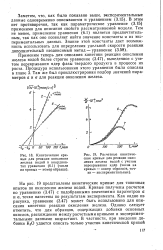
Влияние добавок окислов на кинетику гидрирования карбида железа при 280 С и 1 106 Па ( образец с добавкой А12Оз К2О при 2 - 106Па. ( Зачерненные точки - исходный образец. [3] |
На примере реакции окисления железа водой мы уже видели, что введение добавок может заметно изменить реакционную способность образцов. Менее детально этот вопрос был обсужден для реакции карбидирования железа в связи с методическими трудностями. Однако из данных для последней реакции ясно, что добавки окислов калия и алюминия по разному влияют на реакционную способность. Кроме того, свойства образцов, в которые вводились обе добавки одновременно, неаддитивны. Напротив, для реакции окисления железа свойства образцов, содержащих добавки окислов калия и алюминия, были близки к аддитивным. [4]
Медь способна катализировать реакции окисления железа. [5]
Рассмотрение особенностей макрокинетики реакции окисления железа водой показало, что реакция протекает в кинетической области. В следующих главах мы встретимся с более сложной макрокинетической обстановкой, при которой наблюдаемая кинетика топохимической реакции осложняется влиянием стадий переноса вещества как в газовой, так и в твердой фазе. [6]
Анализ константы равновесия реакции окисления железа монооксидом марганца, который в значительном количестве может находиться в шлаке, показывает, что она растет с повышением температуры. [7]
Найденные значения удельных скоростей реакции окисления железа водой могут быть использованы для получения информации о различных особенностях этой реакции. [8]
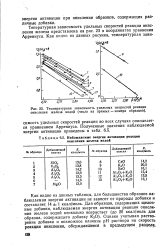 |
Температурная зависимость удельных скоростей реакции окисления железа водой ( числа на прямых - номера образцов.| Наблюдаемые энергии активации реакции окисления железа водой. [9] |
Тепературная зависимость удельных скоростей реакции окисления железа представлена на рис. 23 в координатах уравнения Аррениуса. [10]
Металл разогревается за счет реакции окисления железа и примесей Мп и Si. Температура чугуна по мере выгорания примесей повышается до 1600 С. [11]
Применим теперь для описания кинетики реакции окисления железа водой более строгое уравнение (3.47), выведенное с учетом перекрывания ядер фазы твердого продукта в процессе их роста. Там же был проиллюстрирован подбор значений параметров а и о для реакции окисления железа. [13]
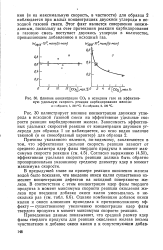 |
Влияние концентрации СО2 в исходном газе на эффективную удельную скорос-ть реакции карбидирования железа. а-образец 1, 230 С. б-образец 2, 220 С. [14] |
В предыдущей главе на примере реакции окисления железа водой было показано, что введение окиси калия существенно изменяет концентрацию дефектов на исходной поверхности железа. [15]
Страницы: 1 2 3 4 5