Реакция - окисление - железо
Cтраница 2
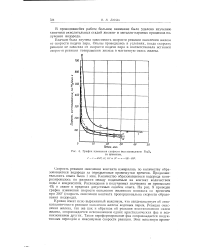 |
График изменения скорости восстановления Fe3O4 со временем. [16] |
Вначале была изучена зависимость скорости реакции окисления железа от скорости подачи пара. [17]
Для определения ферроцианида калия [7] использована реакция окисления железа ( II) сульфатом церия. Полученные результаты отличались приблизительно на 1 5 % от теоретической величины. [18]
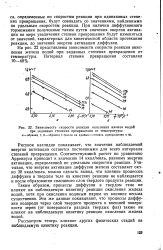 |
Зависимость скорости реакции окисления железа водой. [19] |
На рис. 22 представлены зависимости скорости реакции окисления железа водой при заданных степенях превращения от температуры. [20]
На рис. 24 представлена зависимость удельных скоростей реакции окисления железа при средней температуре эксперимен-тов 90 С от радиуса катиона до - Рис 24 зависимость удельных бавки. [21]
Таким образом, различные методы определения удельных скоростей реакции окисления железа водой приводят к близким значениям. [22]
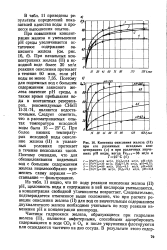 |
Кинетика окисления железа ( II при его различных исходных концентрациях ( а и при различных значениях рН воды, когда Ре с 36 мг / л и Т25 С ( б. [23] |
Из табл. 11 видно, что по ходу реакции окисления железа ( II) рН, щелочность воды и содержание в ней кислорода уменьшаются, а концентрация свободной углекислоты возрастает. Следовательно, подтверждается отмеченное выше положение, что при расчете реакции окисления железа ( II) для вод со значительным содержанием двухвалентного железа необходимо учитывать по ходу реакции изменения рН и концентрации кислорода. [24]
Рассмотрим теперь возможный вклад различных стадий в наблюдаемую кинетику реакции окисления железа водой. [25]
Таким образом, рассмотрение роли физических стадий в наблюдаемой кинетике реакции окисления железа водой показывает, что ни одна из этих стадий не является лимитирующей; скорость суммарного процесса определяется, следовательно, скоростью собственно реакции на поверхности раздела твердых фаз; реакция окисления железа водой в изученных условиях протекает в кинетической области. [26]
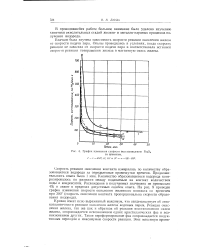 |
График изменения скорости восстановления Fe3O4 со временем. [27] |
Кривая имеет ясно выраженный максимум, что свидетельствует об авто-каталитичности реакции окисления железа водяным паром. Реакция окисления железа, так же как и обратная ей реакция восстановления окиси железа, сопровождается исчезновением одних кристаллических фаз и возникновением других. Такое переформирование фаз сопровождается индуктивным периодом и максимумом скорости реакции. [28]
С целью установления механизма каталитической реакции окисления аш-кислоты пероксидом водорода изучены реакции окисления железа ( II) пероксидом водорода, персульфатом и броматом. [29]
Таким образом, процессы диффузии в твердом теле не влияют на наблюдаемую кинетику реакции окисления железа водой, хотя при окислении водяным паром их влияние весьма существенно. Эти же данные показывают, что процессы диффузии водорода через слой твердого продукта к внешней поверхности зерен ( от поверхности раздела твердых фаз) также не влияют на наблюдаемую кинетику реакции окисления железа водой. [30]
Страницы: 1 2 3 4 5