Реакция - окисление - железо
Cтраница 4
При этом Fe ( OH) 2, выделяющийся на поверхности частиц активного вещества, образует отдельную фазу в виде дисперсного осадка, не препятствующего распространению реакции окисления железа в глубину частиц. Наблюдаемая поляризация при разряде-железного электрода вызвана замедлением диффузии ионов ОН -, скорость которой снижается по мере увеличения толщины слоя продуктов реакции, выделяющихся на поверхности железа. Поляризация возрастает при понижении температуры и повышении разрядной плотности тока. В известных условиях разряд затрудняется образованием на железе поверхностных окислов адсорбционного характера, вызывающих пассивирование электрода. [46]
Благодаря каталитической способности частиц гидроокиси железа в момент их образования, адсорбции СО2 хлопьями взвешенного осадка, а также турбулентной диффузии дисперсных частиц контактная среда усиливает реакцию окисления железа ( II) и обеспечивает высокий эффект обезжелези-вания воды. [47]
Таким образом, рассмотрение роли физических стадий в наблюдаемой кинетике реакции окисления железа водой показывает, что ни одна из этих стадий не является лимитирующей; скорость суммарного процесса определяется, следовательно, скоростью собственно реакции на поверхности раздела твердых фаз; реакция окисления железа водой в изученных условиях протекает в кинетической области. [48]
Реакция окисления железа ( II) идет быстро, без нагревания раствора. Конец реакции определяют по появлению розового окрашивания, вызываемого одной избыточной каплей раствора перманганата калия. Окраска не должна изменяться в течение 1 мин. [49]
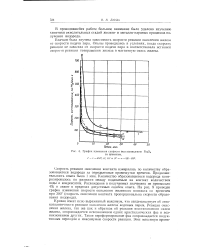 |
График изменения скорости восстановления Fe3O4 со временем. [50] |
Кривая имеет ясно выраженный максимум, что свидетельствует об авто-каталитичности реакции окисления железа водяным паром. Реакция окисления железа, так же как и обратная ей реакция восстановления окиси железа, сопровождается исчезновением одних кристаллических фаз и возникновением других. Такое переформирование фаз сопровождается индуктивным периодом и максимумом скорости реакции. [51]
В качестве флюса используют кремнеземсодержащие материалы - песчаник, кварцит, кварцевый песок. Реакция окисления железа идет со значительно большим выделением тепла, чем реакция окисления сульфида железа, поэтому при продувке никелевого штейна развиваются более высокие температуры, чем при продувке медных штейнов. Продуктами процесса конвертирования никелевых штейнов являются никелевый файнш-тейн ( почти чистый сульфид никеля Ni3S2) и шлак. Шлаки представлены фаялитом, магнетитом, стеклом и включениями корольков металла. [52]
Реакция окисления железа ( II) идет быстро, без нагревания раствора. Конец реакции определяют по появлению розового окрашивания, вызываемого одной избыточной каплей раствора перманганата калия. Окраска не должна изменяться в течение 1 мин. Благодаря этому более отчетливо наблюдается переход окраски от бесцветной к розовой. Чтобы ионы железа ( II) не окислялись кислородом, следует избегать длительного соприкосновения их с воздухом. Все операции - взвешивание, растворение, титрование - должны проводиться быстро. [53]
Реакция окисления железа ( II) идет быстро, без нагревания раствора. Конец реакции определяют по появлению розового окрашивания, вызываемого одной избыточной каплей раствора перманганата калия. Окраска не должна изменяться в течение 1 мин. [54]
Значительно большую роль как источники тепла играют процессы окисления металлов при кислородной резке. На реакции окисления железа основан процесс кислородной резки стали, широко применяющийся в металлообрабатывающей промышленности. Сущность его заключается в следующем: если на предварительно нагретую сталь направить струю кислорода, то железо и легирующие элементы сгорают с образованием жидких легко удаляемых оксидов. При сжигании металла за счет теплопроводности подогреваются прилегающие к месту реза слои, которые как бы подготавливаются к последующему сжиганию. [55]
Эффект реакций окисления железа и хрома при нагреве пакетов усиливается дополнительно развивающейся реакцией взаимодействия между продуктами окисления этих двух металлов. Образующиеся при - этом кристаллы хромита имеют характерный голубовато-зеленоватый оттенок. Как видно из рис. 26, прямая, изображающая зависимость AZr f ( F) pe -, акции образования хромитов железа из элементов, расположена почти параллельно аналогичной прямой для окисления хрома и имеет почти ту же степень вероятности. По своей абсолютной величине изобарные потенциалы этих двух реакций намного превышают остальные, из чего следует, что в рассматриваемой системе эти две реакции должны получить преимущественное развитие. Протекание этих двух реакций должно привести к полному поглощению кислорода воздуха, оставшегося в зазорах между пластинами и стенками пакета. [56]
Левый электрод представляет собой смесь железа и его оксида. Здесь происходит реакция окисления железа ионами О2 -, приходящими через твердый электролит. При этом освобождаются электроны, и электрод получает отрицательный заряд. На правом электроде, состоящем из смеси Мо и МоО3, происходит восстановление оксида. Это сопровождается поглощением электронов таким образом, что электрод заряжается положительно, а освободившиеся ионы О2 - могут мигрировать через электролит к левому электроду. [57]
Левый электрод представляет собой смесь железа и его закиси. Здесь происходит реакция окисления железа ионами О2 -, приходящими через твердый электролит. При этом освобождаются электроны и электрод получает отрицательный заряд. На правом электроде, состоящем из смеси Мо и МоО3, происходит восстановление окисла. Это сопровождается поглощением электронов так, что электрод заряжается положительно, а освободившиеся ионы О2 - могут мигрировать через электролит к левому электроду. Легко видеть, что сумма этих двух реакций 3Fe ( т) МоО3 ( т) 3FeO ( т) Мо ( т) есть процесс восстановления окиси молибдена железом, самопроизвольное протекание которого является источником электрической энергии. [58]
Однако надо заметить, что несмотря на эмоциональную привлекательность линейной зависимости рис. 24, ее общее значение маловероятно. Действительно, если учесть обсуждавшиеся особенности кинетики реакции окисления железа для образцов, содержащих добавки растворимых окислов щелочного характера, то можно предположить, что точки, соответствующие этим окислам, на графике несколько занижены. [59]
 |
Зависимость доли теплоты, выделяемой источниками нагрева при кислородной резке, от толщины металла. [60] |
Страницы: 1 2 3 4 5