Реакция - окисление - метан
Cтраница 2
Однако ири такой температуре скорость реакции окисления метана водяным паром очень мала. Реакция протекает с значительной скоростью лишь при температурах 1350 С и выше. Из-за трудности ведения эндотермического процесса лрк столь высоких температурах в промышленных условиях процесс паровой конверсии метана ведут на катализаторе в при сутствии избытка водяного пара по сравнению со стехиомет-рическим количеством. В табл. 11 приведен рассчитанный Б. П. Корниловым равновесный состав газовой смеси, образующейся в процессе паровой конверсии метана при различных температурах и давлениях и соотношении СН4: Н201: 2 в исходной газовой смеси. [16]
Однако при такой температуре скорость реакции окисления метана водяным паром очень мала. Реакция протекает с значительной скоростью лишь при температурах 1350 С и выше. Из-за трудности ведения эндотермического процесса при столь высоких температурах в промышленных условиях процесс паровой конверсии метана ведут на катализаторе в присутствии избытка водяного пара по сравнению со стехиомет-рическим количеством. В табл. 11 приведен рассчитанный Б. П. Корниловым равновесный состав газовой смеси, образующейся в процессе паровой конверсии метана при различных температурах и давлениях и соотношении СН: Н2О1: 2 в исходной газовой смеси. [17]
Как было установлено ранее [5], реакция окисления метана протекает стадийно и складывается из двух последовательно идущих реакций: CEU - СНзО - - СО. [18]
Кроме того, было осуществлено проведение реакции окисления метана с использованием кислорода воздуха вместо чистого кислорода. [19]
Предлагаемая методика иллюстрируется ниже на примере реакции окисления метана. [20]
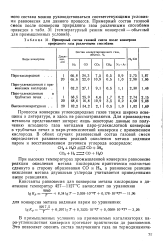 |
Примерный состав газовой смеси после конверсии природного газа различными способами. [21] |
При высоких температурах промышленной конверсии равновесие реакции окисления метана кислородом практически полностью сдвинуто в сторону образования СО и На, а равновесие реакции окисления метана двуокисью углерода учитывается приведенными выше реакциями. [22]
 |
Корреляция между каталитической активностью кобальтитов в отношении реакций окисления водорода и метана и скоростью гомомоде-кулярного обмена кислорода. [23] |
Пониженная активность кобальтита кальция в отношении реакции окисления метана, как было показано специальными опытами, обусловлена отравлением катализатора углекислым газом, образующимся при реакции. [24]
 |
Свойства меднооксидных катализаторов [ 3, с. 196 - 213 ]. [25] |
В табл. 2.5 приведены активности меднооксидных катализаторов в реакции окисления метана и оксида углерода. В случае нанесенных катализаторов следует учитывать влияние структуры носителя на каталитические свойства оксидов. [26]
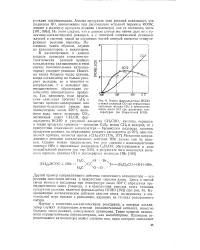 |
Выход формальдегида НСНО и окиси углерода СО при термическом окислении метана СН4 п присутствии окиси азота NO при различных температурах ( по Кармиловой. [27] |
Другой пример направляющего действия гомогенного катализатора - это реакция окисления метана в присутствии окислов азота. Направляющее каталитическое действие окислов азота, по-видимому, в значительной мере связано с реакциями, идущими на стенках реакционного сосуда. [28]
Наиболее изучены реакции конверсии метана водяным паром и реакции окисления метана кислородом. Многочисленные исследования в этом направлении выполнены в Государственном научно-исследовательском и проектном институте азотной промышленности. [29]
Дальнейшие расчеты проведены с целью определения кинетических закономерностей постадийной реакции окисления метана. [30]
Страницы: 1 2 3 4