Реакция - окисление - окись - углерод
Cтраница 1
Реакция окисления окиси углерода с образованием углекислого газа легко осуществляется при высоких температурах. Однако найдено, что этот процесс можно катализировать многими окисями при более низких температурах. На наиболее активных катализаторах, в том числе на Mn02, GuO, CoO и N10, данная реакция проходит даже при комнатной температуре. Найдено, что смеси окисей никеля, кобальта и железа весьма эффективны в форме многокомпонентных катализаторов. Смесь 60 % МпО2 и 40 % CuO также является эффективным катализатором гопкалита. В последнее время значительное внимание уделяется применению AgMn04 с промоторами - окисями металлов. [1]
Реакция окисления окиси углерода в углекислый газ над окис-ными катализаторами имеет сложный механизм, довольно подробно описанный Гарнером с сотрудниками [51 ] и другими авторами. [2]
Реакция окисления окиси углерода сопровождается повышением температуры катализатора, всей верхней части полукамеры и проходящего через нее воздуха. Так как нижняя часть камеры заполнена неактивным веществом, то между ее температурой и температурой верхней части создается некоторая разность, величина которой зависит от концентрации окиси углерода в исследуемом воздухе. Измерение этой разности температур производится с помощью дифференциальной термобатареи и соединенного с ней гальванометра. [3]
Реакция окисления окиси углерода кислородом, имеющая взрывной характер, вовсе не происходит при полном отсутствии водяных паров. В присутствии же влаги эта реакция развивается как цепная. [4]
Механизм реакции окисления окиси углерода имеет характер разветвленной цепной реакции, подобной реакции окисления водорода, однако принадлежит к так называемым сложным цепным реакциям, осложняемым параллельно протекающими сопутствующими реакциями. [5]
Более активные образцы в реакции окисления окиси углерода получаются в условиях, способствующих образованию частично гидролизованных и ассоциированных комплексных катионов, включающих кислород, не принадлежащий цеолитному каркасу, который является более реакционноспособным, чем решеточный кислород. [6]
В системе выпуска двигателей происходят реакции окисления окиси углерода и углеводородов ОГ с избыточным кислородом. СС) проходят с малой скоростью. Для ускорения протекающих реакций используют катализаторы. Механизм действия катализатора сложен. В основе окислительных процессов, протекающих на катализаторах, лежат процессы диссоциативной адсорбции кислорода и продуктов неполного сгорания, вследствие чего скорость их химического взаимодействия резко возрастает. [7]
Из таблицы следует, что в реакции окисления окиси углерода активность обусловлена, по-видимому, Pt-компонентом и падает с увеличением количества рутения, приближаясь к чистому Ru-электроду. [8]
В качестве модельной реакции была выбрана реакция окисления окиси углерода. Все катализаторы этой реакции были разделены по их каталитической активности на три класса и были выбраны 22признака, характеризующие различные физико-химические свойства катализаторов. Решение задачи сводилось к отнесению данного катализатора к тому или иному классу по значениям его признаков, а такжек отбраковке коррелируемых признаков и их ориентировке по степени влиятельности. [9]
В ранней работе Бентона [14], посвященной реакции окисления окиси углерода, предлагался механизм, заключавшийся в чередующихся окислении и восстановлении активного окисного катализатора. [10]
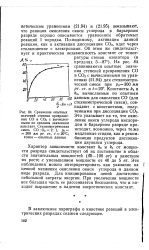 |
Сравнение опытных значений степени превращения СО в СО2 с вычисленными по средним значениям констант. Стехиометрическая смесь СО. О2 2. 1, ро 300 мм рт. ст., t 20 C. точки - опытные данные. [11] |
Фическим уравнениям (21.94) и (21.95) показывают, что реакция окисления окиси углерода в барьерном разряде хорошо описывается уравнением обратимых реакций I порядка. По-видимому, активация данной реакции, как и активация диссоциации СО2, идет через столкновение с электронами. [12]
В нашей работе [8] было показано, что реакция окисления окиси углерода на окиси меди наступает лишь после того, как на кривой температурного хода контактной разности потенциалов Vk ( t) появится минимум. [13]
Принцип действия прибора основан на измерении теплового эффекта реакции окисления окиси углерода до двуокиси угле рода в присутствии катализатора - гопкалита. [15]
Страницы: 1 2 3 4
