Реакция - окисление - углеводород
Cтраница 2
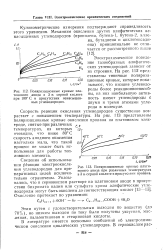 |
Поляризационные кривые платинового анода в 3 н. серной кислоте при 100 С в присутствии ненасыщенных углеводородов. [16] |
Скорость реакции окисления углеводородов существенно возрастает с повышением температуры. С скорость анодного окисления настолько мала, что такой процесс не может быть использован для работы топливного элемента. [17]
Торможение реакции окисления углеводородов при помощи антиокислителей или ингибиторов неразрывно связано с цепным механизмом реакции окисления, осуществляющейся при участии перекисных радикалов. [18]
Условия реакции окисления углеводородов С4 в процессах обеих фирм близки. [19]
Для реакций окисления углеводородов в барьерном разряде характерно образование продуктов неполного окисления, главным образом различных перекисей. Так, при ( Пропускании 584 л смеси метана с кислородом ( 64 % СН4, 35 % О2) через барьерный разряд было получено около 940 г жидкости, содержащей до 9 % активного кислорода. В продуктах фракционированной перегонки этой жидкости обнаружены метилформиат, метиловый спирт, муравьиная кислота, формальдегид и вода. [20]
Скорости реакции окисления углеводородов на простых окис-ных и металлических катализаторах изучены немногими исследователями. Пигулевский [46] показал, что при окислении пропилена на V20s скорость полного сжигания пропорциональна концентрации кислорода. Рейерсон и Свиринген [12] изучили кинетику окисления этилена на платине и нашли, что скорость реакции пропорциональна концентрации кислорода и обратно пропорциональна концентрации этилена. Этот случай возможен при больших заполнениях поверхности углеводородом. [21]
Исследованию реакций окисления углеводородов и использованию продуктов окисления в практике посвящено большое количество работ. Однако пока что в этой области существует много вопросов, подлежащих разрешению как в научном, так и в практическом плане. Вместе с тем в общем балансе углеводородных ресурсов высококипящие нефтяные фракции, состоящие из естественных смесей углеводородов различных классов, представляют основную часть. Поэтому для успешного развития нефтехимической промышленности и науки необходимы систематические и всесторонние исследования процессов окисления различного нефтяного сырья. [22]
Для реакций окисления углеводородов ряд авторов предлагает различные типичные механизмы. [23]
В реакциях окисления углеводородов механизм солевого катали - / за металлами переменной валентности оказывается более сложным. [24]
В реакциях окисления углеводородов часто обнаруживается период индукции, за которым следует очень быстрая реакция. В индукционном периоде в системе образуются следы альдегидов; если с самого начала реакции добавить альдегиды, то индукционный период можно сократить или снять совсем. При окислении углеводородов образуются также перекиси, но их образование можно подавить, обработав стенки реакционного сосуда хлористым калием. [25]
Цепные - реакции окисления углеводородов в жидкой фазе. [26]
С днако реакция окисления углеводородов не останавливается на оэразова. [27]
При рассмотрении реакции окисления углеводородов необходимо учитывать также взаимодействие активных центров с промежуточными веществами, которые, как правило, являются значительно более реакционноспособ-ными, чем исходный углеводород. Прежде все это относится к таким веществам, как альдегиды. [28]
По инициированию реакций окисления углеводородов в жидкой и газовой фазах действием различных инициаторов опубликован ряд работ. [29]
Исследование продуктов реакции окисления углеводородов позволяет сделать предположение о механизме реакции этого процесса. [30]
Страницы: 1 2 3 4