Реакция - окисление - азот
Cтраница 3
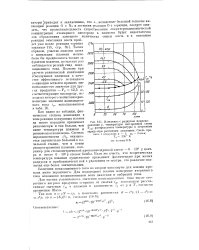 |
Изменение с радиусом пламени. [31] |
О с Na и легкости реакции О с горючим, следует ожидать, что продолжительность существования сверхтермодинамической концентрации атомарного кислорода в пламени будет недостаточна для образования заметного количества окиси азота и в основном реакция окисления азота пройдет уже после реакции горения топлива [ 15, стр. Таким образом, участие окислов азота и ионизации пламени можно было бы предполагать только за фронтом пламени, но там как раз наблюдается резкий спад ионизационного тока. [32]
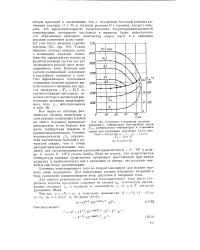 |
Изменение с радиусом пламени. давления р, температуры ней ор евшей смеси Тсм, распределение температуры в сгоревшем. [33] |
О с N2 и легкости реакции О с горючим, следует ожидать, что продолжительность существования сверхтермодинамической концентрации атомарного кислорода в пламени будет недостаточна для образования заметного количества окиси азота и в основном реакция окисления азота пройдет уже после реакции горения топлива [ 15, стр. Таким образом, участие окислов азота в ионизации пламени можно было бы предполагать только за фронтом пламени, но там как раз наблюдается резкий спад ионизационного тока. [34]
Условия образования токсичных компонентов второй группы приблизительно одинаковы для всех видов топлив. Реакция окисления азота в пламени ( как и любая другая химическая реакция - см. раздел 1.2.7) ускоряется с повышением температуры горения. Поэтому условия оптимальные с точки зрения полноты сгорания топлива - минимально необходимый избыток воздуха и его интенсивное перемешивание с топливом - приводят к увеличению скорости реакции образования оксидов азота и их концентраций в продуктах сгорания. Попытки снижения концентраций NOx посредством затягивания процесса перемешивания и снижения за счет этого температуры зоны реакции ( фронта горения) ведут к возрастанию величины химического недожога. Поэтому при сжигании всех видов топлив в одинаковых по температуре зоны горения условиях образуется приблизительно одинаковое количество токсичных компонентов второй группы. [35]
При нагревании воздуха до температуры в несколько тысяч градусов в нем протекают химические реакции, в результате которых образуется довольно значительное количество окиси азота NO. Кроме реакций окисления азота, во фронте воздушной УВ протекает реакция образования двуокиси азота из окиси: 2NO О2 2NO2 107 2кДж / моль. [36]
Если AGjgg - большая положительная величина, то константа равновесия очень мала и равновесие реакции сдвинуто в сторону исхо-ных веществ. Так, для реакции окисления азота YsNsH - V2C2r NOr; Л0 98 87000 Дж / моль и, следовательно, в смеси, в которой pN Ро PNO 1 не будет происходить образование NO, а, наоборот, будет иметь место его диссоциация. [37]
Учет влияния пульсаций температуры и концентрации на среднюю скорость химической реакции представляет большой практический интерес. Этот вьюод наглядно иллюстрируется на примере реакции окисления азота, скорость которой чрезвычайно сильно зависит от температуры. Оценки показывают, что при средней температуре 2000 К и относительно низкой интенсивности пульсаций температуры ( скажем, 10 %) средняя скорость реакции может на порядок отличаться от скорости реакции при средней температуре. [38]
При правильной организации рабочего процесса химические реакции окисления топлива должны завершиться в пределах первичной зоны. После подвода вторичного воздуха из-за снижения температуры практически замораживаются реакции окисления азота. Следовательно, роль смесителя вторичного воздуха сводится к простому разбавлению продуктов сгорания, и его наличие приводит лишь к некоторой неопределенности в оценке длины первичной зоны. Далее, при использовании горелочных устройств с предварительной подготовкой бедной топливовоздушной смеси необходимо изолировать первичную зону от воздушного потока на периферии камеры сгорания, поскольку даже незначительное обеднение состава смеси приведет к преждевременному прекращению окисления топлива и увеличит выход продуктов неполного сгорания. [39]
В тех случаях когда кинетика радиационной реакции подчиняется уравнению вида WKf ( c) [ где / ( с -) - функция, зависящая только от концентрации реагирующих веществ ], зависимость - скорости радиационных реакций от температуры сле-дуег уравнению Аррениуса. На рис. 20 приведены графики зависимости логарифма константы скорости реакции окисления азота под действием медленных электронов от температуры. Прямые, обозначенные цифрами, относятся к различным сериям опытов. Как видно на графике, аррениусовская зависимость для этих опытов выполняется. [40]
В тех случаях когда кинетика радиационной реакции подчиняется уравнению вида W / C / ( c) [ где / ( с -) - функция, зависящая только от концентрации реагирующих веществ ], зависимость скорости радиационных реакций от температуры следует уравнению Аррениуса. На рис. 20 приведены графики зависимости логарифма константы скорости реакции окисления азота под действием медленных электронов от температуры. Прямые, обозначенные цифрами, относятся к различным сериям опытов. Как видно на графике, аррениусовская зависимость для этих опытов выполняется. [41]
Только один тип реакций, свойственный NH3 и NH, не характерен для азота биомолекул. В условиях внутренней среды живой клетки азотсодержащие молекулы не участвуют в реакциях окисления азота. [42]
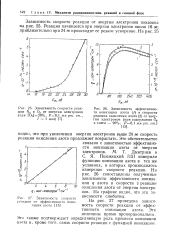 |
Зависимость скорости реак.| Зависимость эффективности ионизации азота ( 1 и скорости реакции окисления азота ( 2 от энергии электронов ( при содержании О2 в смеси - 20 %, Р0 1 мм рт. ст.. [43] |
Я - Пшежецкий [15] измерили функцию ионизации азота в тех же условиях, в которых производилось измерение скорости реакции. На рис. 26 сопоставлены полученные зависимости эффективности ионизации q азота и скорости v реакции окисления азота от энергии электронов. На графике видно, что эти зависимости симбатны. [44]
Иначе говоря, уравнение (5.193) описывает влияние температуры на константу равновесия Кр при постоянном давлении. Влияние это определяется знаком теплового эффекта. Реакции окисления азота (5.187) или превращения метана в ацетилен (5.88), наоборот, эндотермичны ( ДЯ 0), для них константы равновесия с повышением температуры увеличиваются. T) также может служить иллюстрацией принципа Ле-Шателье - Брауна - внешнее воздействие на систему ( в данном случае повышение температуры) вызывает процессы, связанные с поглощением теплоты. [45]
Страницы: 1 2 3 4