Реакция - окисление - азот
Cтраница 4
В промышленности используют метод гомогенного окисления NO в газовой фазе кислородом. Процесс интенсифицируется добавлением кислорода в газовую фазу, но это связано с большим его расходом, так как только 1 % кислорода вступает в реакцию с NO, а остальной выбрасывается в атмосферу. Скорость реакции окисления азота газообразным кислородом увеличивается в присутствии катализаторов. [46]
Это говорит о термической природе реакции окисления азота, не зависящей от способа нагревания азотно-кислородной смеси. [47]
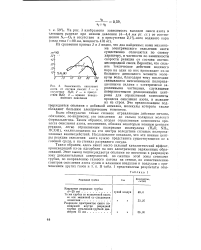 |
Зависимость окисления азота от состава смесей. / - в отсутствие ЬЬО. 2 - в присутствии РЬО. 3 - кривая поверхностного окисления. [48] |
Было обнаружено также сильное отравляющее действие метана, обязанное, по-видимому, его окислению до сильно полярных молекул формальдегида. Таким образом, вторая отравляемая компонента процесса окисления азота, несомненно, обязана некоторым ионным центрам реакции, легко отравляемым полярными молекулами ( НаО, NH3, НСОЫ), налипающими на эти центры вследствие сильных поляризационных взаимодействий. Исследование показало, что эти ионные центры реакции окисления азота нужно представить существующими не в газовой среде, а на стенках разрядного сосуда. [49]
 |
Зависимость окисления азота от состава смесей. / - в отсутствие Н2О. 2 - в присутствии HsO. 3 - кривая поверхностного окисления. [50] |
Было обнаружено также сильное отравляющее действие метана, обязанное, по-видимому, его окислению до сильно полярных молекул формальдегида. Таким образом, вторая отравляемая компонента процесса окисления азота, несомненно, обязана некоторым ионным центрам реакции, легко отравляемым полярными молекулами ( H2U, NH3, НСОЫ), налипающими на эти центры вследствие сильных поляризационных взаимодействий. Исследование показало, что эти ионные центры реакции окисления азота нужно представить существующими не в. [51]
Влияние это определяется знаком теплового эффекта. Для экзотермической реакции ДЯ О производная dlnKp / dT отрицательна и константа равновесия уменьшается с повышением температуры. Реакции окисления азота (5.187) или превращения метана в ацетилен (5.88), наоборот, эндотермичны ( ДЯ 0), для них константы равновесия с повышением температуры увеличиваются. Зависимость Кр f ( T) также может служить иллюстрацией принципа Ле-Шателье - Брауна - внешнее воздействие на систему ( в данном случае повышение температуры) вызывает процессы, связанные с поглощением теплоты. [52]
Страницы: 1 2 3 4