Реакция - неполное окисление
Cтраница 1
Реакция неполного окисления протекает при температуре 330 - 360 С, при этом в реакцию в основном вступают пропан и этан. [1]
Для реакции неполного окисления углеводородов такой зависимости не обнаружено, что указывает на большую роль кислорода и природы связи его с поверхностью в каталитическом процессе. [2]
Катализаторами реакций неполного окисления ациклических органических соединений ( главным образом олефинов и их производных) в кислоты или ангидриды кислот служат обычно сложные контакты на основе окислов молибдена или ванадия. [3]
К реакциям неполного окисления относятся в первую очередь многочисленные реакции превращения углеводородов в спирты, альдегиды, кетоны и карбоновые кислоты, окисления ароматических и других циклических углеводородов, а также различные реакции окисления органических соединений. [4]
Сначала протекает высокоэкзотермическая реакция неполного окисления, избыточное тепло которой расходуется на вторичные реакции. Реакционная система в данном случае является саморегулирующейся, т.е. отклонение эндотермических реакций от равновесия приводит к повышению температуры вследствие уменьшения тепла, что способствует их ускорению. [5]
Большой-интерес представляет реакция неполного окисления изомерных ксилолов. [6]
В результате реакции неполного окисления этана образовывалась сложная смесь кислородсодержащих соединений, состоящая из метилового спирта, формальдегида, ацетальде-гида, муравьиной кислоты, полимеризованных альдегидов и смолы. [7]
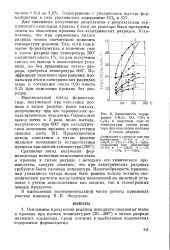 |
Зависимость содержания СН20, СО, СО2 и С2Щ в конечном газе от температуры стенки реактора при окислении пропана в тихом разряде. [8] |
Основными продуктами реакции неполного окисления этана и пропана при низких температурах ( 20 - 300) в тихом разряде являются альдегиды, среди которых в наибольших количествах содержится формальдегид. [9]
Успешное применение реакций неполного окисления парафинов имеет исключительно большое значение для промышленности, так как большая часть продуктов основного органического синтеза представляет собой кислородные органические соединения, которые благодаря доступности исходных парафиновых углеводородов несомненно целесообразнее получать окислением их воздухом или кислородом, чем любыми другими непрямыми способами. [10]
Большой интерес представляет реакция неполного окисления изомерных ксилолов. [11]
Значения констант равновесия реакции неполного окисления метана кислородом изменяются от 4 3 - 1013 при 400Э К до 1 5 - 10й при 1400 К. Эти значения настолько велики, что реакцию ( 9) можно считать практически необратимой. В связи с этим повышение концентрации кислорода в смеси метан - кислород сверх стехиометрического не дает увеличения выхода Н2 и СО. [12]
Подтверждена установленная ранее стадийность реакции неполного окисления метана СШ - СШО - СО. [13]
Поверхность силикагеля сильно катализирует реакцию неполного окисления метана, однако выход формальдегида из-за протекания побочных реакций невысокий. [14]
Для органического синтеза имеют значение реакции неполного окисления углеводородов, которые подразделяются на три основные группы. [15]
Страницы: 1 2 3