Реакция - электрохимическое окисление
Cтраница 3
На катоде происходит реакция электровосстановления, на адоде - реакция электрохимического окисления. В данном случае нас интересуют реакции электрохимического окисления органических соединений. [31]
Круг полярографически определяемых органических соединений несколько расширяется за счет использования реакции электрохимического окисления. Однако для эффективного применения этого метода требуются другие электроды, в основном твердые ( платина, графит и др.) что из-за ряда ограничений ( недостаточная воспроизводимость результатов) не обеспечивает широкого распространения окислительной вольтамперометрии в аналитической практике. [32]
Рассмотрение вышеприведенных кинетических данных показывает, что в большом интервале экспериментальных условий реакция электрохимического окисления анилина в хлорнокислотных растворах является ускоряющейся во времени и характеризующейся рядом интересных кинетических особенностей. Важнейшими из них являются: наличие линейной связи между величинами lg i и г, между величинами К и концентрацией анилина, наличием тормозящего действия окислительного процесса в определенной зоне потенциалов, наличие тормозящего действия растворенного кислорода на окислительный процесс и прохождение через максимум интенсивности окислительного процесса как функции концентрации хлорной кислоты. [34]
 |
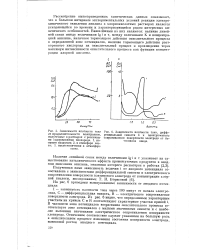
Зависимость высоты первой кислородной ветви поляризационной кривой от рН электролита. [35] |
Изменение механизма выделения кислорода при повышении рН раствора оказывает решающее влияние на направление реакции электрохимического окисления аниона карбоновой кислоты. [36]
Из факта, что единственным результативным процессом на электроде является электроокисление анилина, следует, что скорость реакции электрохимического окисления анилина определяет суммарную скорость электродных процессов, протекающих в этом случае. [37]
 |
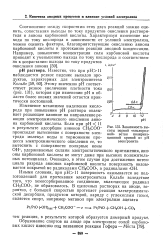
Выход по току хро - растающими по мере умень-мовой кислоты в электролизе - шения содержания в растворах каскада. pg сульфата хрсща. [38] |
Возрастание выхода по току в первых электролизерах каскада объясняется постепенным разложением оставшихся в растворе органических веществ и увеличением доли тока, расходуемого на реакцию электрохимического окисления сульфата хрома. [39]
Кроме перечисленных выше одним из важнейших требований, предъявляемых к электролиту в этом случае, является преимущественное по сравнению с растворителем участие ионов в реакциях электрохимического окисления или восстановления. [40]
Топливным элементом называется химический источник тока, в котором активные вещества поступают к электродам извне; это прямой преобразователь химической энергии в электрическую, в котором реакция электрохимического окисления протекает без расхода вещества электродов, а также без расхода электролита. Исходными реагентами служат компоненты химического топлива-горючее и окислитель, обладающие запасом энергии химических связей, которая преобразуется в энергию постоянного электрического тока. [41]
Соединения, образующиеся при взаимодействии органического реагента с определяемым ионом, наряду с малой растворимостью и химической устойчивостью должны обладать достаточной электро-химической активностью, в то время как используемый реагент, очевидно, должен быть устойчив к реакциям электрохимического окисления и восстановления в достаточно широкой области потенциалов. [42]
Если сравнить значения стационарных потенциалов железа в нейтральных электролитах ( - 0 3 - - 0 5 в) со значениями потенциалов образования окисных слоев, то легко прийти к заключению, что уже при незначительном смещении потенциала от стационарного наряду с процессом ионизации происходит реакция электрохимического окисления. По мере смещения потенциала в положительную сторону процесс окисления все более усиливается, и при достижении потенциала пассивации электрод уже в значительной степени покрывается окисным слоем, приводящим к резкому уменьшению скорости ионизации металла; наступает явление пассивности. [43]
Газометрические катодные кривые ( см. рис. 9) в таком случае отражают следующие процессы. Реакция электрохимического окисления иона гидразония ( 11), сопровождающаяся выделением газа, замедляется; реакция электровосстановления ( 10) ускоряется, но так как она не создает непосредственного газовыделения, то его общая скорость падает до величины, примерно соответствующей каталитическому процессу. Наконец, при некотором значении катодной поляризации начинается электролитическое выделение водорода, приводящее к резкому увеличению скорости газовыделения на электроде и появлению водорода в газовой фазе. [44]
Если допустить, что на электроде в пассивном состоянии продолжают параллельно протекать две электрохимические реакции, а именно анодное растворение металла через окисную пленку и электрохимическое окисление электрода кислородом, то независимость или слабую зависимость скорости анодного процесса от потенциала можно объяснить следующим образом. Однако одновременно ускоряется и реакция электрохимического окисления металла кислорода, а значит, и толщина пленки. Это затрудняет выход катионов металла из решетки в раствор. В результате этих двух противоположно действующих факторов анодный ток остается постоянным или слабо меняется с изменением потенциала. [45]
Страницы: 1 2 3 4