Реакция - полное окисление
Cтраница 2
Используя (III.7), определить, возможна ли реакция полного окисления метана при 600 К в стандартных условиях. [16]
Рассуждая аналогично, можно составить материальный баланс реакции полного окисления любого из тяжелых углеводородов. [17]
Совсем недавно было предложено применять для предотвращения реакции полного окисления небольшие количества паров дихлорэтана [8], тетраэтил-свинца и других антидетонаторов [9]; эти вещества непрерывно вводят в реактор вместе со смесью этилена и воздуха. [18]
Большое влияние на режим работы контактного аппарата оказывает реакция полного окисления этилена, тепловой эффект которой почти в 10 раз больше теплового эффекта основной реакции. Для замедления реакции полного окисления к исходному сырью добавляют такие ингибиторы, как тетраэтилсвинец, ди-бромэтан, бензол, этанол, хлордифенил, хлорполифенил, этилен-хлоргидрин, а при работе в кипящем слое используют твердые галогенпроизводные. [19]
На катализаторах с использованием окиси алюминия в основном протекает реакция полного окисления углеводородов. [20]
Отмечается возможность использования частных закономерностей подбора катализаторов применительно к реакции избирательного и полного окисления этана. [21]
Стандартной энтальпией ( теплотой) сгорания вещества называют энтальпию реакции полного окисления одного моля вещества. Это следствие обычно используют для расчета тешювых эффектов органических реакщй. [22]
С целью изучения влияния дисперсности Pd на его каталитические свойства в реакции полного окисления СН4 исследованы каталитические свойства трех образцов Pd-катализаторов [181]: / - массивный Pd, 2 - катализатор получен пропиткой цеолита Линде 13 раствором хлорпаладата аммония с последующей сушкой на воздухе при 400 С и восстановлением при 300 С. При таком способе получения ионного обмена нет, так как металл находится в анионе. [23]
Повышение температуры хотя и ускоряет процесс, но ведет к развитию реакций полного окисления, имеющих, как правило, более высокую энергию активации. По этой причине для каждого целевого продукта можно найти оптимальную температуру ( или некоторую узкую область температур), при которой достигается высокая скорость реакции при достаточной селективности. [24]
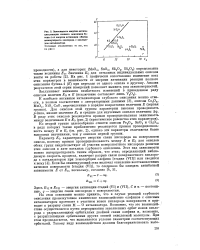 |
Зависимость энергии активации реакции полного окисления бу-тена-1 от энергии активации обмена молекулярного кислорода с кислородом катализатора. [25] |
На рис. 1 графически сопоставлено изменение всех этих параметров в зависимости от энергии активации реакции полного окисления бутена-1 ( Е) при переходе от одного окисла к другому. Анализ результатов этой серии измерений позволяет выявить ряд закономерностей. [26]
При подборе катализаторов окисления этана нами было показано [3, 4], что активность оксидных систем в реакциях полного окисления и дегидрирования определяется энергетическим состоянием поверхностного кислорода. [27]
Энергия активации реакции при гетерогенно-каталитиче-ском окислении ароматических углеводородов составляет - 105 кДж / моль, а реакции полного окисления - 155 кДж / моль. Поэтому подавление параллельной реакции полного окисления за счет варьирования соотношения реагентов обычно оказывается невозможным; определяющую роль играет температура, которую обычно поддерживают в узком интервале. Понижение температуры повышает селективность окисления. [28]
Характерной чертой окисления углеводородов на полупроводниках СшО и У20б и на металлическом Ag является возможность подавления реакции полного окисления путем увеличения работы выхода электрона. Такую связь скорости реакции образования СО 2 и Аф, вероятно, можно объяснить близостью механизмов этой реакции на различных катализаторах. По-видимому, большую роль в образовании СО а играют цепные процессы на поверхности. [29]
Внутренняя восстановительная область отделена от внешней окислительной реакционной зоной - внутренним конусом, в котором реально и протекают реакции полного окисления. Реакционная зона окрашена в зеленовато-голубой цвет, вследствие излучения молекулярных полос радикала Сг, кроме того, в ней присутствуют молекулы N2, 02, СО и другие. Их излучение практически перекрывает весь спектр, поэтому внутренняя восстановительная область не может быть использована для аналитических целей. Внешняя область пламени содержит нагретые до высокой температуры продукты полного сгорания углеводородов, газы воздуха, радикалы и вследствие равновесности реакций также некоторые количества СО, Н, О. Она интенсивно излучает в инфракрасной области спектра и мало излучает в видимой и ультрафиолетовой областях, что делает ее удобным источником эмиссии атомных спектров элементов. [30]
Страницы: 1 2 3 4