Реакция - перенос - протон
Cтраница 3
Между константами скорости и константами равновесия реакций переноса протона в неводных растворах может существовать взаимосвязь. [31]
Применение функции Н при изучении скоростей реакций переноса протона, кинетического изотопного эффекта водорода и механизмов реакций будет рассмотрено в следующих главах. [32]
Две из приведенных в табл. 2.3 реакций переноса протона являются медленными: это реакции с участием сернистой и угольной кислот. [34]
Интересно отметить, что при рассмотрении реакций переноса протона ПФК используется дважды: один раз, когда требуется выравнивание электронных энергий, и второй раз, когда требуется выравнивание уровней энергии протона; это соответствует тому, 4fo скорость движения электрона больше скорости движения протона, а последняя - больше скорости движения диполей растворителя. [35]
Большая подвижность анионов растворителя также определяется реакцией переноса протона: частица растворителя, связанная водородным мостиком с соседней частицей, может передавать ей протон, превращаясь при этом в анион. Образовавшийся анион может оторвать протон от другой молекулы, оставляя таким образом донорную частицу с отрицательным зарядом. [36]
Настоящая книга посвящена главным образом количественным аспектам реакций переноса протона, особенно в водных средах. [37]
В заключение отметим, что для некоторых реакций переноса протона экспериментальные значения & ЭФФ значительно превышают теоретически предсказанные. [38]
В заключение отметим, что для некоторых реакций переноса протона экспериментальные значения & эфф значительно превышают теоретически предсказанные. [39]
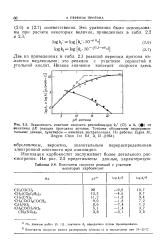
 |
Реакции 2 4 6-тринитробензил иона с фтористым водородом в этаноле [ к % в л / ( моль с ]. [40] |
В работе [21] были измерены скорости нескольких реакций переноса протона в этанольных растворах при низких температурах. [41]
Предположим, что в ферменте, катализирующем реакцию переноса протона, например в фосфоглюкозоизомеразе или в кетостероидизомеразе, основанием, которое удаляет протон от углерода, является имидазольный остаток гистидина. Чтобы произошел протонный обмен, необходим перенос протона от сопряженной кислоты имидазола к растворителю, что может быть результатом реакции с ионом гидроксила или с водой. [42]
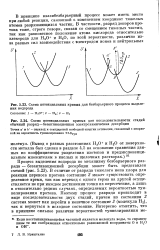 |
Схема потенциальных кривых для безбарьерного процесса выделения водорода.| Схема потенциальных кривых для последовательности стадий обычный разряд - безактивационная электрохимическая десорбция. [43] |
В отличие от разряда тяжелого иона хлора для реакции переноса протона состояние 2 может существовать определенное время, так как переход с одного терма на другой осуществляется не при каждом достижении точки их пересечения, а лишь в относительно редких случаях, определяемых вероятностью туннелирования протона. Поэтому процесс разряда происходит в виде последовательности двух стадий, причем из состояния 2 система может как перейти в конечное состояние 3 ( молекула Н2), так и вернуться в исходное состояние. [44]
Так, образование и разрыв водородных связей, реакции переноса протона, процессы ионной и молекулярной ассоциации, как и следовало ожидать, не ограничивают скорости межфазного переноса, но влияют на ее концентрационные зависимости через изменение движущей силы. Более медленными являются реакции разрушения координационных соединений, причем в пределах гомологических рядов иногда наблюдается корреляция между прочностью указанных соединений и скоростью процесса. Еще более медленными оказываются реакции образования ( разрушения) внутрикомплексных соединений. Другими словами, наблюдается известная тенденция замедления процессов при переходе от ионных реакций к реакциям, требующим перестройки ковалентных связей, а также по мере усложнения химических взаимодействий. [45]
Страницы: 1 2 3 4