Реакция - перенос - электрон
Cтраница 2
При реакциях переноса электрона, как и в случаях ререноса атомов, образуются вполне определенные переходные структуры ( активированные комплексы), способствующие реакции окисления - восстановления. [16]
При реакциях переноса электрона, как и в случаях - переноса атомов, образуются вполне определенные переходные структуры ( активированные комплексы), способствующие реакции окисления - восстановления. [17]
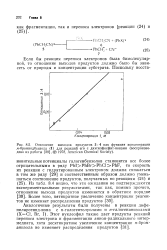 |
Отношение выходов продуктов 3. 4 как функция концентрации л-бромиодбензола ( 1 для реакций его с диэтилфосфит-ионами ( воспроизведено из работы, 1978, American Chemical Society. [18] |
Если бы реакция переноса электронов была бимолекулярной, то отношение выходов продуктов должно было бы зависеть от природы и концентрации субстрата. [19]
 |
Кинетические параметры реакции переноса электрона ( 27. [20] |
Если в реакции переноса электрона участвуют и контактные, и сольватно-разделенные ионные пары, то по причинам, изложенным в разд. [21]
Интересную группу реакций переноса электрона образуют различные реакции окисления, катализируемые ионами марганца. [22]
Данная работа посвящена реакциям переноса электрона с участием возбужденных состояний молекул зондов, растворенных в водных мицеллярных растворах. [23]
Часто отмечается, что реакции переноса электрона сильно катализируются ионами противоположного знака. Реакции ( 160а) и ( 160в) катализируются катионами, а ( 1606) - анионами. Каталитическое воздействие на реакции с обменом электронов можно объяснить встраиванием катиона или аниона в активированный комплекс; противоположный по знаку заряда ион снижает кулоновскую долю энергии активации. Следует лишь отметить, что в этих реакциях можно различать два типа активированных комплексов - внешнесферные комплексы и мости-ковые комплексы. [24]
Реакция (6.65) относится к реакции переноса электрона. [25]
Так, например, реакция переноса электрона от иона ОН - к иону железа ( III) в водном растворе, ведущая к образованию радикала ОН и двухзарядного иона Fe2, казалось бы, должна быть энергетически выгодной. Однако частичная дегидратация ионов железа и гидроксила, обусловленная понижением зарядов этих частиц, требует затраты работы. Энергия переноса электрона ( если нет каких-либо осложняющих реакцию процессов) равна разности между сродством к электрону и разностью теплот гидратации начальных и конечных продуктов. [26]
Кинетика и механизм таких реакций переноса электрона обсуждались в разд. [27]
Термодинамические и кинетические характеристики реакции переноса электрона следует рассматривать одновременно, так как многие энергетически возможные реакции идут настолько медленно, что их нельзя использовать в аналитических целях. [28]
По-видимому, маловероятно, чтобы реакции переноса электрона протекали путем перехода электрона от восстановителя к окислителю, осуществляемого в свою очередь посредством переноса к молекуле воды ( растворителя), находящейся не в гидратной оболочке иона. [29]
Такие эксиплексы образуются в результате реакции переноса электрона с донора на возбужденные катионы гетероароматических соединений. [30]
Страницы: 1 2 3 4