Реакция - радикал
Cтраница 1
Реакции радикалов характеризуют истинные химические стадии; это отличает их от реакций молекул, когда стехиометри-ческое уравнение получают объединением большого числа элементарных стадий. Кинетические параметры ( константы скорости, энергии активации, предэкспоненциальные множители) радикальных реакций удается во многих случаях рассчитать, используя термодинамические функции, что позволяет сократить объем эксперимента при определении этих параметров, критически оценить результаты эксперимента. [1]
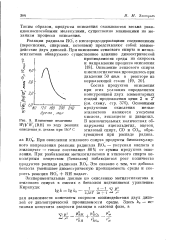 |
Изменение величины WjYWi [ RH ] по ходу реакции окисления н. декана при 140 С. [2] |
Реакции радикала R02 с кислородсодержащими соединениями ( перекисями, спиртами, кетонами) представляют собой взаимодействие двух диполей. [3]
Реакции радикалов - NF, характеризуются энергиями активации, превышающими энергии активации других радикальных реакций. Так, энергия актива -: ции реакции с изобутиленом составляет 12 5 ккал / моль, с моноокисью фтора - 21 ккал / моль, с фтором - : 20 4 ккал / моль и с трехфтористым хлором - : 23 5 ккал / мшь. [4]
Реакции радикалов с НС1 имеют энергии активации, лишь немного ( примерно на 1 ккал / моль) превышающие эндотермичность реакции. [5]
Реакции радикалов друг с другом ( одинаковых или различных) и радикалов с молекулами называются радикальными реакциями. [6]
Реакции радикалов радикальные нецепные 57 ел. [7]
Реакция радикала С2Н5 с исходным углеводородом превращает его в конечный продукт С2Н6 и замыкает цепь. При распаде радикалов по р - С - Н - связи выделяется водород. [8]
Реакция радикала С2Н5 с исходным углеводородом превращает его в конечный продукт С - tHe и замыкает цепь. При распаде радикалов по Р - СВЯЗИ С - Н выделяется водород. [9]
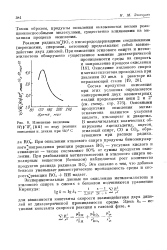 |
Изменение величины W / YWi [ RH ] по ходу реакции окисления н. декана при 140 С. [10] |
Реакции радикала Н02 с кислородсодержащими соединениями ( перекисями, спиртами, кетонами) представляют собой взаимодействие двух диполей. [11]
Реакции радикалов пли ионов, образующихся таким образом при разложении гидроперекисей, очень разнообразны; в последующем делается попытка показать влияние условий и среды на их поведение. Трактовка механизма реакций, которая при этом приводится, часто недостаточно убедительна и вероятно будет уточняться в дальнейшем. [12]
Реакции радикалов пли ионов, образующихся таким образом при разложении гидроперекисей, очень разнообразны; в последующем делается попытка показать влияние условий и среды на их поведение. Трактовка механизма реакций, которая при этом приводится, часто недостаточно убедительна и вероятно будет уточняться в дальнейшем. [13]
Реакции радикалов RO приводят к образованию макромолекулярных нитратов, спиртов и карбонильных соединений. Энергия активации отрыва атома водорода от ПЭ составляет 56 - 68 кДж / моль, а от ПП - 60 кДж / моль. [14]
Реакции радикалов ОН с органическими веществами в основном подобны реакциям, наблюдаемым в случае атомарного водорода. [15]
Страницы: 1 2 3 4