Реакция - радикал
Cтраница 2
Реакция радикала инициатора с мономером зависит от реакционной способности двойных связей в нем. Так, радикальная по-лимер изация этилена протекает с большим трудом ( в промышленности этот процесс проводят при 150 - 200 С и давлении 100 - 150 МПа) главным образом вследствие низкой активности двойной связи. Наличие в молекуле мономера электроположительного ( галоген, нитрильная и карбоксильная группы) или электроотрицательного ( метильная группа) заместителя приводит к поляризации двойной связи в молекуле мономера. Этот эффект проявляется в увеличении дипольного момента и соответственно в повышении скорости полимеризации. [16]
Реакции радикалов цепи с молекулами замедлителя должны протекать быстрее, чем реакции рекомбинации радикалов цепи. [17]
Реакция радикалов R с кислородом идет быстро и практически без затраты энергии. Количество гидропероксида, образующегося на начальных стадиях окисления, практически соответствуют количеству поглощенного кислорода. [18]
Реакции радикалов цепи с молекулами ингибитора протекают быстрее, чем реакции рекомбинации радикалов цепи. [19]
Реакция перекисных и окисных радикалов с ароматическими фосфитами не изучена совсем. [20]
Обычно реакции радикалов бывают двух типов: мономолекулярные ( перегруппировка или разрыв связей) и бимолекулярные; последние, в свою очередь, подразделяются на процессы с разрушением радикалов и реакции, дающие новые свободные радикалы. [21]
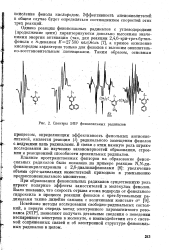 |
Спектры ЭПР феноксильных радикалов. [22] |
Однако реакции феноксилъных радикалов с углеводородами ( продолжение цепи) характеризуются довольно высокими значениями энергии активации ( так, для реакции 2 4 6-три-трет. [23]
Разнообразны реакции аммиачных радикалов в присутствии окиси азота NO в пламенах Нечетное число внешних электронов на внешней оболочке окиси азота обусловливает высокую реакционную способность этой молекулы, делая ее как бы промежуточным звеном между насыщенными молекулами и радикалами. [24]
Разнообразны реакции аммиачных радикалов в присутствии оксида азота NO в пламенах. Нечетное число внешних электронов на внешней оболочке оксида азота обусловливает высокую реакционную способность этой молекулы, делая ее как бы промежуточным звеном между насыщенными молекулами и радикалами. [25]
Разнообразны реакции аммиачных радикалов в присутствии оксида азота N0 в пламенах. Нечетное число внешних электронов на внешней оболочке оксида азота обусловливает высокую реакционную способность этой молекулы, делая ее как бы промежуточным звеном между насыщенными молекулами и радикалами. [26]
Тип реакции радикалов в радикальной паре зависит от ее электронной конфигурации. Как правило, продукты реакции клеточдой рекомбинации или диспропорционирования возникают из синглетного состояния радикальной пары. [27]
Для реакций радикалов с алкенами возможна конкуренция мономолекулярного распада с бимолекулярными процессами присоединения и замещения. [28]
Для реакций радикалов с алкенами возможна конкуренция мономолекулярного распада с бимолекулярными процессами присоединения и замещения. Направление и скорость реакции в этом случае в большой степени определяются давлением: при температуре выше 727 С и давлении 0 1 МПа бимолекулярные реакции практически неосуществимы. При температуре 427 С и таком же давлении бимолекулярные реакции протекают, но медленно - их скорость примерно в 7 раз меньше скорости распада. При температуре 427 С и давлении 1 МПа бимолекулярные реакции становятся преобладающими. [29]
Изучению реакций радикалов в облученных веществах уделялось очень большое внимание, поскольку эти реакции являются предшественниками образования болыпей части стабильных продуктов радиолиза. [30]
Страницы: 1 2 3 4