Реакция - перекисный радикал
Cтраница 1
Реакция перекисного радикала с кетоном с точки зрения электростатического взаимодействия представляет собой реакцию между двумя диполями в полярной среде. Установлено, что константа kz уменьшается по мере разбавления метилэтилкетона неполярным растворителем - бензолом, н-де-каном, n - дихлорбензолом и четыреххлористым углеродом. Изменение k2 обусловлено неспецифической сольватацией исходных частиц и активированного комплекса. [1]
Реакция перекисных радикалов с ароматическими эщирами пирокатехина фосфористой кислоты, содержащий трет. [3]
Конкуренция реакций перекисного радикала ( распад пере-кисного радикала п его реакция с исходным углеводородом с образованием перекиси), повидимому, характерна для всех реакций окисления углеводородов. [4]
Конкуренция реакций перекисного радикала ( распад последнего и его реакция с исходным углеводородом с образованием перекиси), по-видимому, характерна для всех реакций окисления углеводородов, в том число и для окисления углеводородов в жидкой фазе. [5]
Сопоставление констант скоростей реакций перекисных радикалов с разными эфирами возможно только в том случае, если с последними будут реагировать одни и те же перекисные радикалы. Если для этих перекисных радикалов известна константа скорости рекомбинации, то из относительных значений констант скорости можно рассчитать абсолютные, зная ( или измерив) скорость инициирования в условиях опытов. [6]
Образование гидроперекисей происходит вследствие реакции перекисного радикала. [7]
Количественное измерение скоростей различных направлений реакции перекисного радикала в таком сложном процессе представляет существенные трудности, поскольку из кинетических данных могут быть получены только скорости накопления промежуточных продуктов, представляющие собой разности между скоростями их образования и расходования. [8]
Была проведена количественная оценка5 скоростей двух направлений реакции перекисного радикала ( ш4 и w2) в жидкой и газовой фазах в процессе окисления н-бутана при температуре 145 С и давлении 50 ат. [9]
Была проведена количественная оценка5 скоростей двух направлений реакции перекисного радикала ( wi и w2) в жидкой и газовой фазах в процессе окисления н-бутана при температуре 145 С и давлении 50 ат. [10]
Так как в основу процесса радиационного окисления положены реакции перекисных радикалов, то необходимо установить, является ли радикал RO2 предшественником гидроперекисей, карбонильных соединений и спиртов. [11]
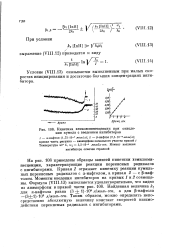 |
Кинетика хемилюминесценции при окислении кумола с введением ингибиторов. [12] |
На рис. 108 приведены образцы записей кинетики хемилюминесценции, характеризующие реакции перекисных радикалов с ингибиторами. Кривая 1 отражает кинетику реакции кумиль-ных перекисных радикалов с а-нафтолом, а кривая 2 - е 3-иаф-толом. Моменты введения ингибиторов на кривых 1 и 2 совмещены. Найденная величина k7 для ос-нафтола равна ( 3 1) - 105 л / молъ-сек, а для р - нафтола - ( 3 1) - 10 л / молъ-сек. [13]
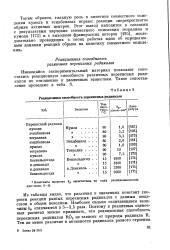 |
Реакционная способность перекисных радикалов. [14] |
Из таблицы видно, что различия в значениях констант скорости реакции разных перекисных радикалов с данным веществом в общем невелики. Наиболее сильно отличающиеся величины Ар отличаются в 3 - 3 5 раза. [15]
Страницы: 1 2 3
