Реакция - перекисный радикал
Cтраница 2
Не исключено, что образование циклогексанола непосредственно из циклогексана объясняется реакцией перекисного радикала с катионом металла переменной валентности ( железа), растворенном в окисляющемся циклогексане. Такое объяснение хорошо согласуется с фактом участия солей металлов переменной валентности в реакции продолжения цепи ( см. гл. [17]
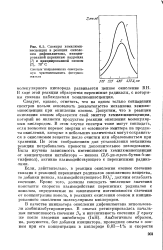 |
Спектры хемилюми-несценции в реакции окисления дифенилметана, инициированной перекисью лауроила ( 1 и инициированной озоном ( 2, 70 С. [18] |
Если, действительно, в реакции окисления озоном свечение связано с реакцией перекисных радикалов окисляемого вещества, то добавки ионола, взаимодействующего с R02, должны ослаблять свечение. Кроме того, должны совпадать численные значения константы скорости взаимодействия перекисных радикалов с ионолом, определяемые по зависимости интенсивности свечения от концентрации ионола, в реакциях окисления озоном и инициированного окисления молекулярным кислородом. [19]
При изучении механизма реакции продолжения цепи установлено, что представление Н. Н. Семенова о конкуренции двух реакций перекисного радикала оказывается справедливым не только для газофазных реакций, но и для процессов окисления органических соединений в жидкой фазе. [20]
При изучении механизма реакции продолжения цепей было установлено, что представление Н. Н. Семенова [24] о конкуренции двух реакций перекисного радикала справедливо не только для газофазных реакций, но и для процессов окисления органических соединений в жидкой фазе. Наряду с основной реакцией продолжения цепей в некоторых случаях протекает изомеризация перекисных радикалов, сопровождающаяся разрывом связи С-С. [21]
Из приведенной схемы видно, что лактоны и кетокислоты могут образовываться и в результате изомеризации а-кетопере-кисного радикала, и по реакции перекисного радикала с другими метиленовыми группами кетона. [22]
На основании экспериментальных данных по влиянию температуры и мощности дозы гамма-излучения на скорость окисления предложен механизм окисления циклогексанола, в котором бирадикальная реакция перекисных радикалов является стадией продолжения цепного процесса окисления, и рассчитаны отношения констант скоростей реакций роста и обрыва цепей. [23]
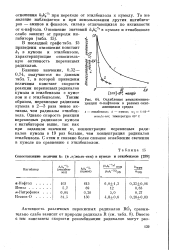 |
Ослабление хемилюминес-ценции а-нафтолом в разных окисляющихся средах. [24] |
Близкие значения, 0 32 - 0 74, получаются по данным табл. 7, в которой приведены величины констант скорости реакции перекисных радикалов кумола и этилбензола с кумо-лом и с этилбензолом. Таким образом, перекисные радикалы кумола в 2 - 3 раза менее активны, чем радикалы этилбензола. [25]
 |
Взаимное расположение атомов в перекисных радикалах. [26] |
Это затрудняет образование а-дигидроперекисей, и они должны образовываться с небольшим выходом, что и наблюдается на опыте. Наоборот, реакция перекисного радикала со связью С - Н в Р - и у-аоложении не имеет пространственных затруднений и должна протекать сравнительно легко. В соответствии с этим Р - и у-дигидроперекиси получаются с высоким выходом. [27]
Если, исходя из этого, принять, что продукты крекинга получаются не из пропильных радикалов, то в наших условиях другая возможность для их образования может возникнуть уже только па следующей стадии процесса - на стадии перекисных пропильных радикалов. Действительно, реакция перекисного радикала с 02 вообще мало вероятна, реакция же его с С3Й8 сможет привести либо к гидроперекиси пропила, либо ( как это предполагает Гиншельвуд [18]) к дипропилпереки-си. [28]
 |
Взаимное расположение атомов в перекисных радикалах. [29] |
Это затрудняет образование а-дигидроперекисей, и они должны образовываться с небольшим выходом, что и наблюдается на опыте. Наоборот, реакция перекисного радикала со связью С - Н в Р - и у-положении не имеет пространственных затруднений и должна протекать сравнительно легко. В соответствии с этим Р - и у-дигидроперекиси получаются с высоким выходом. [30]
Страницы: 1 2 3