Реакция - разложение - перекись - водород
Cтраница 2
Так, энергия активации реакции разложения перекиси водорода 2Н2О2 2Н2О О2 составляет 17 - 18 ккал / моль, в присутствии ионов железа она снижается до 10 - 11, а в присутствии фермента каталазы ( тоже содержащего ионы железа) - до 1 - 1 5 ккал / моль. Этот пример, как и многие другие, показывает, что обычные катализаторы снижают энергию активации на 4 - 7, а ферменты на 16 - 18 ккал / моль. Скорость реакции при действии ферментов возрастает в среднем в 1012 раз. [16]
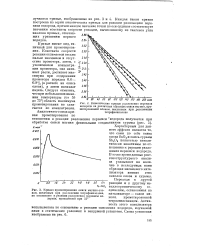
К вопросу о ценном характере реакций разложения перекиси водорода под действием пероксидазы и каталазы. [17]
 |
Схема установки для каталитического разложения перекиси водорода. [18] |
До последнего времени считалось, что реакция разложения перекиси водорода подчиняется мономолекулярному закону только в случае ускорения ее мелкодисперсными металлами. [19]
Хорошо изученной жидкофазной цепной реакцией является реакция разложения перекиси водорода. Доказательством цепной природы процесса является высокий квантовый выход фотохимической реакции, а также ее способность замедляться при добавках ничтожных количеств некоторых соединений. [20]
Хорошо изученной жидкофазной цепной реакцией является реакция разложения перекиси водорода, Доказательством цепной природы процесса является высокий квантовый выход фотохимической реакции, а также ее способность замедляться при добавках ничтожных количеств некоторых соединений. [21]
Двуокись марганца служит прекрасным катализатором и для реакции разложения перекиси водорода, которая в обычных условиях идет чрезвычайно медленно. [22]
Таким образом, мы видим, что реакция разложения перекиси водорода действительно первого порядка. [23]
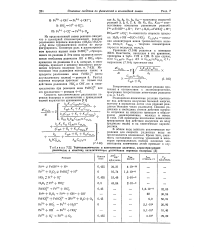 |
Термодинамические и кинетические величины, характеризующие равновесие и кинетику каталитического разложения перекиси водорода. [24] |
Из представленной схемы реакции следует, что в суммарной стехиометрической реакции разложения перекиси водорода ( 2Н2Ог - Н2О СЬ) ионы трехвалентного железа не могут фигурировать. [25]
Каждая такая кривая построена из серии кинетических кривых для реакции разложения перекиси водорода, причем каждое значение точки по оси ординат соответствует значению константы скорости реакции, вычисленному из тангенса угла наклона прямых, отвечающих уравнению первого порядка. [27]
Материал электрода должен поэтому обладать-каталитической способностью по отношению к реакции разложения перекиси водорода. [28]
Первое исследование каталитической активности органических полупроводников по отношению к реакции разложения перекиси водорода, выполненное Куком [ 91, относится к 1938 г., когда о наличии полупроводниковых свойств у органических соединений ( в частности у фталоцианинов) ничего не было известно. Из изученных автором фталоцианинов Си, Zn, Pt, Ni, V, Fe каталитической активностью обладал лишь фталоцианин железа. [29]
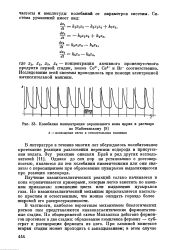 |
Колебания концентрации окрашенного иона церия в растворе. [30] |
Страницы: 1 2 3 4