Реакция - анодное растворение
Cтраница 2
Среди различных случаев выпрямления, исследованных теоретически В. Г. Левичем с сотрудниками, наибольший интерес представляет реакция анодного растворения германия, обладающего электронной проводимостью. Поскольку концентрация дырок в объеме германия, обладающего электронной проводимостью, чрезвычайно низка, то в ходе анодного растворения возникает своего рода концентрационная поляризация по дыркам. Следствием ее является ограничение скорости процесса. В общем случае в реакциях на полупроводниковых электродах принимают участие свободные заряды обоих знаков: свободные электроны и дырки. [16]
Образующаяся на поверхности германия в процессе анодной поляризации окисная пленка не обладает пассивирующими свойствами и не тормозит реакцию анодного растворения, пока не возникнут затруднения с удалением продуктов реакции от поверхности электрода. [17]
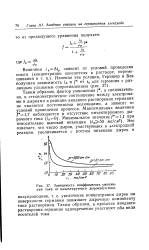 |
Зависимость коэффициента умножения тока от инъектируемого дырочного тока. [18] |
Таким образом, фактор умножения /, а следовательно, и стехиометрическое соотношение между электронами и дырками в реакции анодного растворения германия не являются постоянными величинами, а зависят от условий проведения процесса. [19]
В данном случае химический состав образующихся продуктов коррозии не имеет значения, так как вычисляют непосредственно потерю металла в результате протекания реакции анодного растворения. В соответствии с потерей массы ( см. табл. 1) можно определить балл коррозионной стойкости, предполагая, что металл разрушается равномерно. [20]
Принцип электрохимической защиты от коррозии сводится к катодной поляризации металлического подземного сооружения током от внешнего источника, в результате чего потенциал защищаемого сооружения достигает величины, при которой реакция анодного растворения металла практически прекращается. В качестве внешнего источника тока используются установки катодной защиты, основными элементами которой являются: катодная станция, анодное заземление и соединительные провода и кабели. Установки катодной защиты применяются в основном при защите от почвенной коррозии, однако используются и для защиты от блуждающих токов. [21]
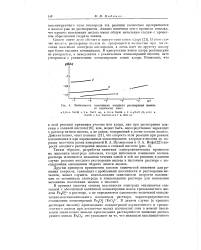 |
Зависимость потенциала анодного растворения железа от плотности тока. [22] |
Такай образом, разработка кинетики электрохимических процессов на железном электроде показала, что при небольшом изменении состава раствора изменяется механизм течения одной и той же реакции, в данном случае реакции анодного растворения железа в щелочном растворе с последующим выпадением гидрата закиси железа. [23]
Ввиду того что толщина электрода меньше его диффузионной длины, дырки, возникающие в результате реакции восстановления феррицианида калия ( кривая 1), инъектируются через толщу электрода к индикаторной стороне и уменьшают величину потенциала протекающей там реакции анодного растворения германия. Влияние инъекции резко уменьшается, если одновременно с реакцией восстановления КзРе ( СМ) б происходит процесс выделения водорода. [24]
Реакция анодного растворения происходит в указанном выше порядке, но дополнительно на поверхности металла протекают еще и другие реакции. Анодному растворению способствует приложенный извне потенциал, обусловленный присоединением анодно растворяющегося образца к внешнему катоду батареи. На поверхности корродирующего металла расположены рядом аноды и катоды, и любой корродирующий образец содержит катодные участки, на которых скорость реакции всегда должна быть электрохимически эквивалентна скорости анодной реакции. [25]
Таким образом, все описанные выше экспериментальные данные, однозначно показывают, что в процессе анодного растворения кремния / г-типа на его поверхности возникает потенциальный барьер, препятствующий нереходу ионов в раствор, и что электрохимическая реакция протекает с участием дырок, которые генерируются в зоне пространственного заряда. Суммарная скорость реакции анодного растворения определяется поверхностной концентрацией дырок. Нужно отметить, что последний вывод справедлив только тогда, когда образующаяся на поверхности кремния окисная пленка хорошо растворима в электролите. [26]
Все это вносит в кинетику электродного процесса много новых особенностей, которые не наблюдаются на обычных металлических электродах. Большинство из них проявляется пр реакции анодного растворения германия. [27]
Характерной особенностью реакций с участием неосновных носителей является возникновение предельного тока, вызванного падением поверхностной концентрации этих носителей до нуля и замедленным диффузионным подводом их из объема полупроводника. Подробно изученной реакцией такого типа является реакция анодного растворения германия. В первой стадии этой реакции [ Ge - - Ge ( lI) ] участвуют дырки, а во второй [ Ge ( II) - Ge ( IV) ] - электроны. [28]
Таким образом, используя различные окислители, находящиеся в растворе, металлу можно задать потенциал как в активной, так и в пассивной области. Это проиллюстрировано на рис. 1.10 для реакции анодного растворения никеля в серной кислоте. Из рисунка видно, что скорость реакции растворения никеля при заданном потенциале от внешнего источника напряжения практически совпадает со скоростью его растворения, определенной по анализу раствора, в растворе окислителя, навязывающего никелю тот же потенциал. [29]
При добавлении поверхностно-активных анионов скорость увеличивается. Отсюда следует, что первой стадией реакции анодного растворения металла является стадия адсорбции аниона с образованием химической связи с атомом металла. Эта связь облегчает последующие стадии отрыва атома ( иона) из кристаллической решетки и его сольватации. Стадия адсорбции может быть связана с одновременным поверхностным перемещением растворяемого атома в более выгодное положение ( например, из положения 3 в положение 1, см. рис. 15.4), где облегчено образование адсорбционных и сольватационных связей. [30]
Страницы: 1 2 3