Реакция - рекомбинация - радикал
Cтраница 2
При термораспаде сэндвич-соединений также возможны реакции рекомбинации радикалов. Так, при пиролизе никелоцепа обнаружено и доказано присутствие 9 10-дигидрофульвалена [17] - продукта димеризации Ср-радика-лов, которые также зарегистрированы масс-спектроскопически. [16]
 |
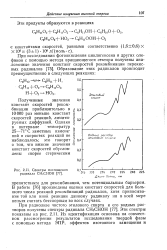
Зависимость константы скорости рекомбинации перекисных ( а и фторалкильных ( б радикалов от температуры. [17] |
Таким образом, энергия активации реакции рекомбинации перекис-ных радикалов составляет в кристаллической фазе 26 3 ккал / моль, а в аморфной фазе 11 3 ккал / моль. [18]
В, - константа, характеризующая реакции рекомбинации радикалов ( индекс обозначает i - й радикал), L - число молекул в единице объема при температуре пламени и 0 - стехиометрический коэффициент, учитывающий разбавление избыточным компонентом смесей, отличающихся от стехиометрических. [19]
Параллельно с этой реакцией протекают также реакции рекомбинации радикалов, поэтому радиационный выход радикалов ( 2) оказывается небольшим. Предварительное облучение образца, создавая повышенные концентрации двойных связей, увеличивает вероятность реакции алкильного радикала с двойной связью и приводит к росту величин G и а. При достаточно больших дозах предварительного облучения практически все радикалы, образующиеся в первичном акте, захватываются при высокой температуре двойными связями, не успевая рекомбинировать, и радиационный выход радикалов оказывается близким к радиационному выходу при - 80 С. [20]
Методом кислородного послеследствия найдены константы скорости реакции рекомбинации радикалов К4 и Кв в окисляющемся кумоле по кинетике установления стационарного режима, регистр рируемой по хемилюминесценции. [21]
CsHs с любыми молекулами & з-константа скорости реакций рекомбинации радикалов &4 - константа скорости распада C2Hs на С2Н4 и Н; [ R ] и [ М ] - соответственно концентрации радикалов и молекул в системе t - время пребывания в реакционной зоне. [22]
С другой стороны, расчет показывает, что реакция рекомбинации радикалов, по-видимому, имеет маленькую положительную энергию активации - порядка 0 5 - 1 ккал. Отрицательная энергия активации в бимолекулярных реакциях не имеет смысла. [23]
В силу сказанного представляет интерес вычисление стерических факторов реакций рекомбинации радикалов и возникновения некоторых из них посредством молекулярных реакций второго порядка. [24]
Для полного согласия с опытом достаточно принять, что реакция рекомбинации радикалов имеет энергию активации порядка 0 5 - 1 ккал / моль. [25]
Поскольку, как было показано, хемилюминесценция возникает в реакциях рекомбинации радикалов, можно было предполагать, что появление в системе новых радикалов, замена одного сорта радикалов другим будет приводить к изменению интенсивности свечения. Специально поставленные опыты подтвердили это предположение [220-222], показав, что интенсивность свечения действительно зависит от химического состава системы и изменяется при введении добавок различных веществ. Основываясь на выводе о рекомбинационной природе хемилюминес-ценции, удается объяснить химическое действие различных добавок их влиянием на концентрацию свободных радикалов и на состав радикалов. [26]
Реакции радикалов цепи с молекулами ингибитора протекают быстрее, чем реакции рекомбинации радикалов цепи. [27]
 |
Спектры поглощения радикала СН3СНОН. [28] |
В работе [76] произведены оценки констант скоростей для большого числа реакций рекомбинаций радикалов, хотя приписывание той или иной реакции данному радикалу ни в коей мере нельзя считать бесспорным во всех случаях. [29]
Реакции радикалов цепи с молекулами замедлителя должны протекать быстрее, чем реакции рекомбинации радикалов цепи. [30]
Страницы: 1 2 3 4