Реакция - диеновый синтез
Cтраница 1
Реакции диенового синтеза были открыты ( 1928 г.) и исследованы немецкими химиками О. [1]
Реакция диенового синтеза обладает резко выраженпой стереохимической направленностью. Конфигурация аддукта определяется на основании следующих основных принципов ( 27, 127 ], обычно известных как правила Альдера. [2]
Реакция диенового синтеза подобно многим синхронным реакциям мало чувствительна к кислотно-основному катализу и нечувствительна к действию ускорителей ( промоторов) и стабилизаторов ( ингибиторов) реакции. [3]
Реакция диенового синтеза, подобно многим синхронным реакциям, малочувствительна к кислотно-основному катализу и нечувствительна к действию ускорителей ( промоторов) и стабилизаторов ( ингибиторов) реакции. [4]
Реакции диенового синтеза являются обратимыми. [5]
Реакция диенового синтеза широко применяется для получения органических соединений различных классов и производства многих важных продуктов, используемых в самых разнообразных областях сельского хозяйства и промышленности. Направления использования этой реакции весьма многочисленны и охватывают большое число разделов органической химии. [6]
Реакция диенового синтеза с полигалоидциклопентадиенами также полностью подчиняется этим правилам. [7]
Реакции диенового синтеза ( реакция Дильса - Альдера) и возможный механизм се протекания уже были подробно рассмотрены ранее ( см. разд. Следует только отмстить, что шести-членные карбоциклическнс структуры образуются лишь в тех случаях, когда в диене имеются две, а в диенофиле одна углерод-углеродные связи. [8]
Реакция диенового синтеза характеризуется ясно выраженной стерео-химической направленностью, а именно: присоединение диенофила к диену, по-видимому, всегда яляется цис-присоединением. [9]
Реакции диенового синтеза ( реакция Дильса - Альдера) и возможный механизм ее протекания уже были подробно рассмотрены ранее ( см. разд. Следует только отметить, что шести-членные карбоциклические структуры образуются лишь в тех случаях, когда в диене имеются две, а в диенофиле одна углерод-углеродные связи. [10]
Реакция диенового синтеза между стиролом и сопряженной системой гало-генированных о-бензохинонов [604] легко протекает уже при комнатной температуре и обычном давлении и, еще легче, при температуре кипения водяной бани. Если реакцию проводят в бензольном растворе, то стирол стабилизируют гидрохиноном. В результате образуется дикетон, обладающий канареечно-желтым цветом, и поэтому о конце реакции можно судить визуально - по изменению окраски реакционной смеси от красной до желтой. Если во время реакции подавать в реакционную смесь эквивалентное количество воды, то после охлаждения дикетон получается в виде бесцветного кристаллогидрата. При восстановлении бензольного раствора гидрата вода отгоняется, и после охлаждения остатка вновь возникает характерная для дикетона желтая окраска. [11]
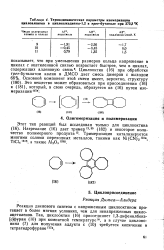 |
Термодинамические параметры изомеризации циклоалкинов в циклоалкадиены-1 2 в трег-бутаноле при 373 3 К. [12] |
Реакция диенового синтеза с напряженным циклооктином протекает в более мягких условиях, чем для ненапряженных цикло-ацетиленов. [13]
Реакция диенового синтеза используется в промышленном масштабе для получения ряда продуктов. [14]
Реакции диенового синтеза являются обратимыми. [15]
Страницы: 1 2 3 4