Реакция - кислотно-основное взаимодействие
Cтраница 1
Реакции кислотно-основного взаимодействия в применении к фосфатным вяжущим были изучены и Кингери [39], который исследовал влияние кислотности жидкости затворения и химического состава порошковой части цементов на прочность образцов отвердевшего фосфатного цемента. Было установлено, что максимальные значения прочности получаются при относительно медленном взаимодействии основных или амфотерных окислов ( катионов с небольшими ионными радиусами) с фосфорной кислотой, а также отмечено влияние экзотермии реакции на кристаллизацию новообразований и роль кислых фосфатов в процессе связывания частиц наполнителя. [1]
Реакции кислотно-основного взаимодействия между кислотами и основаниями могут протекать не только в водных и неводных растворах, но и в вакууме ( между протонами и электронами), в воздушной сфере, в различных газовых средах, в сжиженных газах, в жидких ( в том числе и индифферентных) растворителях и расплавах. [2]
Реакции кислотно-основного взаимодействия, разумеется, протекают более сложно, чем это представлено приведенными выше уравнениями, выражающими конечную стадию этого взаимодействия. [3]
Физически обоснованными реакциями кислотно-основного взаимодействия являются реакции переноса протонов с изменением кислотных ( основных) свойств веществ. Их протекание обусловлено межмолекулярным или внутримолекулярным переносом протона. [4]
В реакциях кислотно-основного взаимодействия происходит обмен протонов, в окислительно-восстановительных - обмен электронов между веществами, участвующими в реакции. [5]
В ходе реакции кислотно-основного взаимодействия существенно изменяется электрическая проводимость раствора, поэтому во многих случаях для обнаружения точки эквивалентности используют кондуктометрические измерения. Эффективно применяют в кислотно-основных методах фотометрическое и термометрическое титрование и некоторые другие. Физико-химические способы фиксирования точки эквивалентности рассмотрены во второй части учебника. [6]
Тепловые эффекты реакций кислотно-основного взаимодействия, комплексообразования и других реакций экспериментально могут быть найдены или по температурному коэффициенту констант равновесия ( некалориметрический метод), или путем прямых калориметрических измерений. Хотя тепловой эффект реакции не должен зависеть от метода определения, все же нередко величины, полученные по температурному коэффициенту констант равновесия, существенно отличались от результатов калориметрических определений иногда даже по знаку. Одной из основных причин возникновения противоречий такого рода является, по-видимому, пренебрежение температурной зависимостью теплового эффекта. В практических расчетах зависимость ДЯ от Т часто не учитывают, ссылаясь на так называемый сравнительно узкий температурный интервал, внутри которого тепловой эффект принимается постоянным. [7]
Наряду с реакциями кислотно-основного взаимодействия в аналитической химии применяются также реакции окисления - восстановления в неводных растворах. [8]
Определение основано на реакции кислотно-основного взаимодействия индикатора родамина 6ж с изо-фталевой кислотой. [9]
Определение основано на реакции кислотно-основного взаимодействия индикатора родамина 6ж с изо-фталевой кислотой. [10]
Калориметрическому измерению теплот реакций кислотно-основного взаимодействия обычно предшествует исследование равновесий и выбор оптимальных концентрационных условий проведения калориметрического опыта. Равновесия в растворах многоосновных кислот удобно представить в виде так называемых диаграмм равновесия, показывающих относительное содержание отдельных продуктов ступенчатой диссоциации в зависимости от рН раствора. Доля каждой частицы рассчитывается по уравнениям типа (XI.43), считая анион кислоты центральным ионом, а ионы водорода лигандам. [11]
В титриметрии находят применение реакции кислотно-основного взаимодействия, окислительно-восстановительные реакции, реакции комплексообразова-ния и осаждения. [12]
Наиболее широко применяется в реакциях кислотно-основного взаимодействия и для определения рН растворов стеклянный электрод. [13]
В отличие от теории Бренстеда реакции кислотно-основного взаимодействия, по ПЭГ, не заключаются в простом переходе протонов от кислоты к основанию. [14]
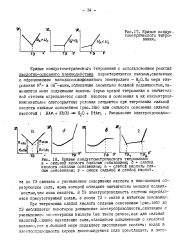 |
Кривые кондуктометрического титрования. а - сильной кислоты сильным основанием. б - слабой кислоты сильным основанием. в - слабой кислоты слабым основанием. г - смеси сильной и слабой кислот. [15] |
Страницы: 1 2 3 4