Реакция - тип
Cтраница 2
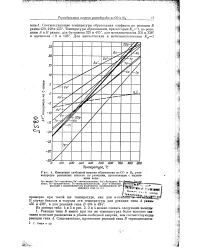 |
Изменения свободной энергии образования из СО и Н2 углеводородов различных классов по реакциям, протекающим с выделением воды. [16] |
Реакции типа Б имеют при тех же температурах более высокие значения констант равновесия и убыли свободной энергии, чем соответствующие реакции типа А. [17]
Реакции типов 1 и 2, наиболее распространенные и представляющие наибольший интерес, одновременно являются наиболее трудными с точки зрения теоретического исследования. Реакции тина; встречаются крайне редко. Тем не менее этот случай представляет большой интерес, так как он допускает количественные исследования. [18]
Реакции типа ( 1а) протекают при очень низких температурах как в водных, так и в углеводородных средах. [19]
Реакции типа ( а, п) и ( а, 2п), например, реакция Be ( a, n) С12, как уже отмечалось, являются удобными лабораторными источниками нейтронов. Первая искусственно вызванная ядерная реакция (5.1) была осуществлена именно на естественных а-частицах. [20]
Реакция типа б соответствует электрофильной перегруппировке, часто встречающейся в алифатическом ряду. Она приводит к образованию карбокатиона, который в дальнейшем может претерпевать различные превращения и вызывать перегруппировки ( см. стр. [21]
Реакция типа в приводит к образованию ненасыщенного соединения. [22]
Реакции типа - пуш-пулл, протекающие в результате одновременного нуклеофильного и электрофильного действия и принадлежащие к линейному типу, включают возникновение переходного состояния I, при котором все три реагента связаны. [23]
Реакции типа Б вероятны до более высоких температур, чем соответствующие реакции типа А. Практически верхний предел образования высших углеводородов любого типа лежит около 500 С. [24]
Реакция типа 11 является основной во многих промышленных процессах, рассмотренных в последующих главах учебника, например при окислении сернистого газа, абсорбции серного ангидрида, синтезе аммиака, окислении окиси азота, синтезе хлористого водорода, синтезах высокомолекулярных соединений и во многих других органических и неорганических, синтезах. [25]
Реакции типов 1 и 2 могут быть исследованы методом молярных отношений только в том случае, если удается соответственно изменить свойства системы путем замены растворителя. Реакции типа 3 требуют для спектрофотометрического исследования применения кювет с чрезвычайно малой толщиной слоя, так как в обычных кюветах толщина слоя не позволяет проводить измерения при необходимых концентрациях. В этом случае может быть применен дифференциальный метод. Измеряют Е раствора с отношением у Д ( / по сравнению со стандартным раствором с отношением у. [26]
Реакции типа ( 35) довольно распространены; они были применены для получения акво-комплексов из соответствующих карбонатных комплексов. [27]
Реакции типа (6.3.2) широко используются для синтеза многочисленных функциональных материалов, т.е. материалов со специфическими магнитными, электрическими, оптическими, теплофизическими свойствами. Типичным примером может служить синтез ферритов - магнитных диэлектриков. [28]
Реакции типа радикал - радикал могут протекать двумя путями: димеризации или диспропорционирования. Для СН ( ОН) СН3 возможны оба процесса, тогда как для - С ( ОН) - ( СНз) г доминирует диспропорционирование. Оба процесса имеют место, например, для радикалов циклогексадиенильного типа [98], гидроксициклопентильных [72] и 2-гидрокситиенильных [107] радикалов, согласно [ itj) Для радикалов, которые могут легко восстанавливаться или окисляться, подавляющим процессом является диспропорционирование. [29]
Реакции типа б подробно рассматриваются в гл. [30]
Страницы: 1 2 3 4