Реакция - третье - порядок
Cтраница 2
Реакции третьего порядка ( тримолекулярные) г. стречаются крайне редко, а реакции порядка выше третьего едва ли существуют. Обычно реакции высоких порядков совершаются путем ряда последовательных моно - или бимолекулярных стадий. [16]
Реакция третьего порядка может также наблюдаться при повышенных концентрациях брома ( но не хлора) в неполярных растворителях. [17]
Реакция третьего порядка не имеет места при присоединении хлора, она протекает только при наличии в молекуле галогена хотя бы одного атома иода или брома. [18]
Реакции третьего порядка весьма редки. Наиболее хорошо изучены реакции N0 с 02, 2NO - - 02 - - - 2N02 118 ] и 2NO C. Было также показано, что рекомбинации атомов ( например. [19]
Реакции третьего порядка вследствие низкой скорости их имеют малое практическое значение. [20]
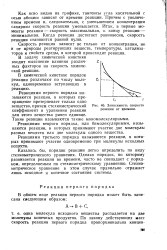 |
Зависимость скорости реакции от времени. [21] |
Реакциями третьего порядка называются реакции, в которых принимают участие одновременно три молекулы исходных веществ. [22]
Реакциями третьего порядка являются также процессы рекомбинации атомов или свободных радикалов в молекулы. Например Н Н - М - - Н2 М, где М - третья частица, которой отдается избыточная энергия. Такие реакции относятся к элементарным и для них значения молекуляр-ности и кинетического порядка совпадают. [23]
Реакциями третьего порядка являются также процессы рекомбинации атомов или свободных радикалов в молекулы. Например Н - Н - М - Н2 М, где М - третья частица, которой отдается избыточная энергия. Такие реакции относятся к элементарным и для них значения молекуляр-ности и кинетического порядка совпадают. [24]
Для реакции третьего порядка в формулу для расчета со должны входить кроме константы реакции три концентрационных сомножителя. [25]
Для реакции третьего порядка 2NO 02 - 2М02 константа скорости уменьшается с ростом Т ( см. разд. [26]
Для реакций третьего порядка период полупревращения обратно пропорционален квадрату начальной концентрации реагирующих веществ. [27]
Скорость реакций третьего порядка пропорциональна произведению концентраций трех реагирующих веществ, причем их начальные концентрации могут быть равны между собой a b - b или неравны. [28]
Для реакций третьего порядка скорость реакции пропорциональна произведению концентраций трех реагирующих веществ, причем их начальные концентрации могут быть равны или не равны друг другу. [29]
Примером реакции третьего порядка может служить тримолекуляр-ная реакция Х2 2NO 2NOX, обратная приведенной выше реакции второго порядка. [30]
Страницы: 1 2 3 4