Реакция - углеводород
Cтраница 2
Изучение реакций углеводородов дает возможность уяснить некоторые характерные особенности подобных многостадийных реакций, а также некоторые физические требования, которые следует выполнить, чтобы чисто формальная кинетическая схема последовательных реакций могла быть приложена к реальным процессам. [16]
Химизм реакций углеводородов на алюмосиликатном катализаторе сводится в основном к расщеплению их с одновременным перераспределением водорода; в результате образуются бензин и газ с относительно малым содержанием непредельных и бедный водородом кокс, отлагающийся на катализаторе. Активность катализатора оценивают количеством бензина, образующегося при участии этого катализатора. Для алюмосиликатных катализаторов установлена определенная шкала индексов активности; так, индекс активности 40 означает, что на данном катализаторе можно в течение 10 мин. Знание индекса активности важно для подбора катализатора применительно к данному сырью. Более легкое сырье требует, более высоких индексов активности катализатора. [17]
Катализаторы реакций углеводородов на основе цеолитов типа А, дезактивированные отложениями кокса и соединениями серы, предлагается [152] регенерировать путем обработки газом ( Н2, N2), содержащим соединения галогенов ( НС1, СН3С1, СС14, трет - С4НдС1), выжигом кокса кислородсодержащим газом и последующим восстановлением водородом. Обработка галогенсодержащими соединениями позволяет полностью удалить серу и предотвратить блокировку пор цеолита ионами SO4, которые могут образоваться в процессе окислительной регенерации. [18]
Большинство реакций углеводородов нефти характеризуется небольшими скоростями и соответственно значительными энергиями активации. Для увеличения скорости реакции приходится повышать температуру или применять катализаторы. Как известно, для большинства реакций при повышении температуры на 10 С скорость реакции увеличивается в 2 - 4 раза. Повышением температуры и достигается требуемая степень превращения исходного сырья. [19]
Большинство реакций углеводородов нефти характеризуется небольшими скоростями и соответственно значительными величинами энергии активации. Для увеличения скорости реакции приходится повышать температуру или применять катализаторы. Как известно, для большинства реакций при повышении температуры на 10 град скорость реакции увеличивается в 2 - 4 раза. Повышением температуры и достигается требуемая глубина превращения исходного сырья. [20]
Большинство реакций углеводородов нефти характеризуется небольшими скоростями и соответственно значительными энергиями активации. Для увеличения скорости реакции приходится повышать температуру или применять катализаторы. Как известно, для большинства реакций при повышении температуры на 10 С скорость реакции увеличивается в 2 - 4 раза. Повышением температуры и достигается требуемая степень превращения исходного сырья. [21]
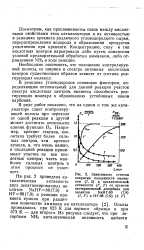 |
Зависимость степени покрытия поверхности аммиаком ( 1, 2 и каталитической активности ( /, 2 от времени изотермической десорбции для цеолитов МаНУ - 80 ( 7 9 ( Л 1 и НУ-98 ( 7 9 ( 2, 2. [22] |
В реакциях углеводородов основным фактором, определяющим оптимальный для данной реакции участок спектра кислотных центров, является способность реагирующих молекул к образованию устойчивых ионов карбония. [23]
В реакциях углеводородов ион карбония легче всего образуется из олефинов. [24]
О реакциях более высококипяших полициклических нафтеновых и смешанных арилнафтеновых углеводородов имеются лишь ограниченные сведения. Эти реакции могут привести как к повышению, так и снижению содержания нафталинов в легком циркулирующем крекинг-газойле. Например, в результате реакций переноса водорода ( 4в) и ( Г б) увеличивается количество нафталинов за счет превращения тетралинов и декалинов, но одновременно выход нафталинов снижается вследствие превращения более высококипяших полициклических нафтенов и смешанных арилнафтеновых соединений ( например, тетрагидро -, октагидро - и пергидрофенан-тренов и - антраценов) в исходный ароматический аналог. [25]
Следовательно, реакции углеводородов этого типа увеличивают образование МОг вдобавок к реакциям фотолитического цикла двуокиси азота. Таким образом, вышеприведенная схема реакций обеспечивает механизм увеличения концентрации озона. Реакция ( 18) превалирует над реакцией ( 6) окисления NO в NO2, и поэтому реакция ( 6) не играет существенной роли в уменьшении концентрации озона. Таким образом, реакция ( 2) дает озон, но в утренние часы в атмосфере она малоэффективна. [26]
Обычно при реакции углеводорода с галогенами образуется смесь веществ различной степени галогенирования. [27]
Обычно при реакции углеводорода с галогенами и образуется смесь веществ, являющихся различными ступенями галогенирования. [28]
Обычно при реакции углеводорода с галогенами образуется смесь веществ, являющихся различными ступенями галогенирования. [29]
Обычно при реакции углеводорода с галогенами образуется смесь веществ, протестированных в различной степени. [30]
Страницы: 1 2 3 4