Реакция - фенилирование
Cтраница 2
АН СССР было изучено влияние давления ( до 6000 ат) на изомерный состав продуктов реакции фенилирования трет, бутилбензола. [16]
Фе-нилазотрифенилметан быстро разлагается при 60 С и дает фенильные радикалы; более стабильный тритиль-нын радикал не участвует в реакции фенилирования. [17]
Помимо определения характера и относительных количеств продуктов, образующихся при реакции нафталина с перекисью бензоила, реакционная способность ядер нафталина была измерена методом конкурентной реакции с нитробензолом. Перекись бензоила не является подходящим для этой цели реагентом, так как для нафталина доминирующей реакцией будет бензоилоксилирование, в то время как для нитробензола преобладает реакция фенилирования. Поэтому исследование конкурентной реакции проведено при 20 с использованием N-нитрозоацетанилида в качестве источника фе-нильных радикалов. [18]
Помимо определения характера и относительных количеств продуктов, образующихся при реакции нафталина с перекисью бензоила, реакционная способность ядер нафталина была измерена методом конкурентной реакции с нитробензолом. Перекись бензоила не является подходящим для этой цели реагентом, так как для нафталина доминирующей реакцией будет бензоилоксилирование, в то время как для нитробензола преобладает реакция фенилирования. Поэтому исследование конкурентной реакции проведено при 20 с использованием N-нитрозоацетанилида в качестве источника фе-нильиых радикалов. [19]
Мы уже видели при рассмотрении реакций электрофильного и нуклеофильного замещения в ароматическом ряду, что наиболее характерен двухстадийный механизм реакции, когда продукт присоединения реагента является малостабильным интермедиатом. Действительно, показано, что реакция фенилирования не сопровождается существенным кинетическим изотопным эффектом водорода. [20]
Как и в случае других радикальных реакции, наиболее медленной стадией является генерация свободных радикалов, поэтому определение относительных реакционных способностей различных ароматических соединений проводилось методом конкурирующих реакций. Этот метод вполне корректен только в том случае, если стадия присоединения является необратимой. Хотя это н предполагается для реакции фенилирования, но, по-видимому, это не всегда так, особенно при проведении реакции при высоких температурах. [21]
Как и в случае других радикальных реакций, наиболее медленной стадией является генерация свободных радикалов, поэтому кинетика реакции и определение относительных реакционных способностей различных ароматических соединений проводилось методом конкурентных реакций. Этот метод вполне корректен только в том случае, если изучаемая реакция является необратимой. Хотя это и предполагается для реакций фенилирования, но, по-видимому, это не всегда так, особенно при проведении реакции при высоких температурах. [22]
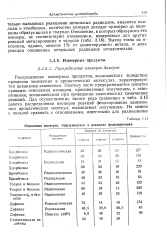 |
Отношения изомеров, образующихся в реакциях фенилирования. [23] |
Распределение изомерных продуктов, возникающих вследствие процессов замещения в ароматических молекулах, характеризует тип механизма замещения. Поэтому часто предпринимается попытка сравнить отношения изомеров, производимых излучением, с отношениями, возникающими при проведении классических химических реакций. Для осуществления такого рода сравнения в табл. 3.15 даются распределения изомеров реакций фенилирования замешенных ароматических молекул, вызываемых излучением. [24]
Метильныо группы, кроме того, не обмениваются на другие группы при использовании фтористого водорода как катализатора. Толуол, смешанный с фтористым водородом, при нагревании в течение продолжительного времени до 200 регенерируется без изменений, не образуя ни ксилолов, ни смолы. Фенильные группы также устойчивы по отношению к этой реакции. Реакции фенилирования, так же как и реакции метилирования, фтористым водородом не катализируются. [25]
Страницы: 1 2