Реакция - хлорирование - метан
Cтраница 1
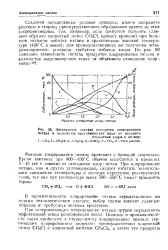 |
Зависимость состава продуктов хлорирования метана и количества выделяющегося тепла от мольного. [1] |
Реакция хлорирования метана протекает с большой скоростью. ГЗрсмя контакта при 400 - 450е С обычно колеблется в пределах 5 - 10 сек и зависит от отношения хлор: метан. При хлорировании метана, как и других углеводородов, следует избегать значительного повышения температуры и местных перегревов реагирующих газов, так как при температуре выше 500 - 550е С может произойти. [2]
Реакция хлорирования метана может быть осуществлена в тихом электрическом разряде. [3]
Реакция хлорирования метана в кипящем слое катализатора - кварцевого песка - при соотношениях С12: СН4 1 5 идет в основном в кинетической области. Скорости диффузионных процессов здесь более высокие, чем скорости химических реакций. Поэтому ход всего процесса подчиняется кинетическим закономерностям последовательной бимолекулярной необратимой реакции. [4]
Подобно реакции хлорирования метана протекает взаимодействие с хлором многих предельных углеводородов; реакция идет сравнительно медленно и приводит к образованию смеси различных продуктов. [5]
Состав продуктов реакции хлорирования метана зависит главным образом от молярного отношения хлора к метану, вступившего в реакцию. На рис. 1, построенном по литературным данным, видно, что максимальное образование хлористого метила получается при отношении хлора к метану 0 8: 1, причем в продуктах реакции имеются метиленхлорид и хлороформ. При отношении хлора к метану 1 7: 1 в продуктах реакции имеются все хлорпроизводные метана; количество метиленхлорида в этом случае наибольшее. При отношении хлора к метану 2 6: 1 образуется главным образом хлороформ. С увеличением отношения хлора к метану растет тепловой эффект реакции. [6]
 |
Хлорирование н-ундекана в присутствии двуокиси азота ( 2 %. [7] |
При исследовании реакции гомогенно-каталитического хлорирования метана в присутствии NO2 методом раздельного кало-риметрирования [20] было найдено, что энергия активации при хлорировании метана в присутствии 2 6 % NO2 снижается до 29 ккал / моль. Одновременно наблюдается повышение глубины превращения углеводорода. Так, при молярном отношении метан: хлор, равном 2: 1, в присутствии двуокиси азота глубина превращения углеводорода увеличилась примерно в четыре раза. [8]
При изучении реакции гомогенно-каталитического хлорирования метана в присутствии N02 методом раздельного кало-риметрирования [19] было найдено, что энергия активации снижается по сравнению с чисто термическим процессом, а глубина превращения углеводорода возрастает. [9]
Протекающая таким образом реакция хлорирования метана может продолжаться до полного замещения атомов водорода. [10]
Протекающая таким образом реакция хлорирования метана может продолжаться до полного замещения атомов водорода. [11]
Основное условие для успешного осуществления реакций хлорирования метана - правильная дозировка и тщательное смешение реагирующих хлора и метана при достаточно эффективном отводе реакционного тепла во избежание взрывного процесса. [12]
На основании полученных данных по изучению скорости реакции хлорирования метана в различных условиях можно прийти к заключению, что реакция в газовой фазе проходит со скоростью значительно большей, чем выделение хлора из расплава, которое и предопределяет скорость реакции в целом. Установлено также, что сплав не только служит источником хлора, но и катализирует реакцию хлорирования в газовой фазе. [13]
 |
Прибор для проведения реакции хлорирования метана окисью хлора. [14] |
На рис. 16 изображен прибор для проведения реакции хлорирования метана окисью хлора. [15]
Страницы: 1 2 3