Реакция - хлорирование - метан
Cтраница 2
Пиз и Вальц [10] экспериментально нашли значение энергии активации реакции хлорирования метана, которая оказалась равной 31 6 ккал / моль. [16]
Проведенный расчет подтвердил, что при соотношениях С12: СН41 5 реакция хлорирования метана во взвешанном слое катализатора - активированого угля - протекает в соответствии с закономерностями последовательной бимолекулярной необратимой реакции с преимущественным образованием четыреххлористого углерода. [17]
Проблемы, связанные с предсказанием скоростей реакции, обсуждаются на примере реакции хлорирования метана. [18]
Проблемы, связанные с предсказанием скоростей реакции, обсуждаются на примере реакции хлорирования метана. Этот пример хотя и сложен, но хорош тем, что может быть разбит на несколько простых стадий. Установленные при этом принципы применяются далее к случаям образования смесей изомеров при реакциях замещения. [19]
Окисление НС1 идет во всем объеме расплава на катализаторе, в то время как реакции хлорирования метана и хлорма-танов, а также их окисление - на поверхности расплава. Кро ме того, эти реакции протекают на разных активных центрах, причем присутствие катионов переходных металлов в центрах, на которых идет хлорирование, не обязательно. [20]
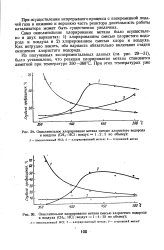
Из полученных экспериментальных данных ( см. рис. 29 - 31), было установлено, что реакция хлорирования метана становится заметной при температуре 350 - 360 С. [22]
Такой сплав содержит на 30 молей хлористого калия 70 молей меди. Была исследована скорость реакции хлорирования метана в реакторе с механическим перемешиванием, а также в аппарате с движущейся пленкой расплава и изучен состав продуктов хлорирования метана. Ряд опытов был поставлен в реакторе барботажного типа. Данные, полученные при измерении скорости реакции в статической системе, показали, что в пределах давлений от 60 мм до 33 5 атм скорость реакции не зависит от давления. При увеличении скорости перемешивания расплава от 0 до 350 об / мин, отмечается небольшое ускорение реакции. [23]
После этого циркуляционный газ смешивается в узле смешения 5 с метаном ( поток Я. На схеме энергетическим потоком Я13 показан тепловой эффект реакции хлорирования метана, а потоком Я14 - тепло, отбираемое от реакционного газа на стадии разделения. [24]
 |
Более детальное рас-смотрение четырех стадии процесса хлорирования метана. Изогнутые стрелки указывают направление движения неспаренного электрона. [25] |
Обычно принятый механизм должен объяснять все, что известно о реакции. Рассмотрим, как предложенный выше механизм объясняет некоторые аспекты реакции хлорирования метана. [26]
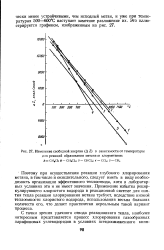 |
Изменение свободной энергии ( Д Z в зависимости от температуры. [27] |
Поэтому при осуществлении реакции глубокого хлорирования метана, в том числе и окислительного, следует иметь в виду необходимость организации эффективного теплоотвода, хотя в лабораторных условиях это и не имеет значения. Применение избытка рецир-кулирующего хлористого водорода в реакционной системе для снятия тепла реакции хлорирования метана требует, вследствие низкой теплоемкости хлористого водорода, использования весьма больших количеств его, что делает практически нереальным такой вариант процесса. [28]
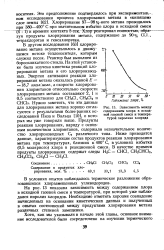 |
Зависимость между содержанием хлора в исходной газовой смеси и температурой пиролиза хлорида. [29] |
В другом исследовании [63] хлорирование метана осуществлялось в движущемся потоке теплоносителя, которым служил песок. Реактор был выполнен из боросиликатного стекла. На этой установке была изучена кинетика реакций хлорирования метана и его хлорпроизвод-ных. Энергия активации реакции хлорирования метана оказалась равной Е 18 7 ккал / моль, а скорости хлорирования хлорметанов относительно скорости хлорирования метана составляют 2, 1 и 0 5 соответственно для СН3С1, СН2С12 и СНСЬ. Нужно заметить, что эти данные для хлорирования метана хорошо согласуются с результатами более ранних исследований Пиза и Вальца [ 101, о которых мы уже говорили выше. [30]
Страницы: 1 2 3