Реакция - электролиз
Cтраница 3
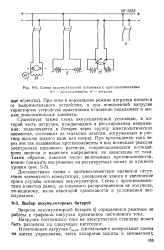 |
Схема аккумуляторной установки с противоэлементами. [31] |
При прохождении тока через эти так называемые противоэлементы в них возникает реакция электролиза щелочного раствора, сопровождающаяся поглощением энергии и падением напряжения, не зависящим от тока. [32]
Выход цинка по току зависит от распределения количества затрачиваемого электричества между двумя реакциями электролиза. [33]
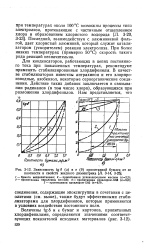 |
Зависимость tg6 ( а и е ( б пропитанной бумаги от ее. [34] |
Последний, взаимодействуя с алюминиевой фольгой, дает хлористый алюминий, который служит катализатором ( ускорителем) реакции электролиза. При более низких температурах ( примерно 50 С) скорость такого рода реакций незначительна. [35]
Электрический ток, получающийся в химических реакциях при работе батареи или разряде аккумулятора, может быть использован для проведения других электрохимических реакций, чаще всего - реакций электролиза. [36]
Этот факт, который не явился для нас вполне неожиданным, может быть, вероятно, объяснен тем, что псевдомеконин, как это известно, гораздо более инертен, чем меконин; так, например, псевдомеконин довольно устойчив к действию окислителей. Механизм реакции электролиза ге-мипиновой кислоты может быть объяснен несколько иной схемой, чем в случае фталевой кислоты. [37]
При этом, однако, не всегда катионы и анионы электролита разряжаются, принимая или отдавая электроны. Часто-в реакциях электролиза принимает участие растворитель - электролит, например вода. [38]
Реакции электролиза являются такими же химическими реакциями, как и все остальные. Поэтому по реакциям электролиза можно производить стехиометрические расчеты точно так же, как это было сделано для других реакций. [39]
Главная трудность метода сопряжена с необходимостью использовать переменный ток. Постоянный ток вызвал бы реакции электролиза на электродах, и поэтому природа раствора вблизи электродов изменялась бы в ходе намерений; это называется поляризацией электродов. Применение переменного тока исключает электродную реакцию, поскольку та поляризация, которая происходит, когда ток течет в одном направлении в первом полуцикле, уничтожается, когда ток течет в противоположном направлении в следующем получик. [40]
Главная трудность метода сопряжена с необходимостью использовать переменный ток. Постоянный ток вызвал бы реакции электролиза на электродах, и поэтому природа раствора вблизи электродов изменялась бы в ходе намерений; это называется поляризацией электродов. [41]
Главная трудность метода сопряжена с необходимостью использовать переменный ток. Постоянный ток вызва бы реакции электролиза на электродах, и поэтому природа раствора вблизи электродов изменялась бы в ходе намерений; это называется поляризацией электродов. Применение переменного тока исключает электродную реакцию, поскольку та поляризация, которая происходит, когда ток те ет и одном направлении в первом полуцикле, уничтожается, когда ток течет в противоположном направлении в следующем полуцикле. [42]
ЭКП дает прекрасную возможность для селективного окисления и восстановления. Аллен 17 ] описал большое число реакций электролиза органических соединений; мы приводим здесь только некоторые из них. [43]
 |
Схема аккумуляторной установки с противоэлементами. [44] |
Наилучшими характеристиками обладают щелочные противоэлементы с пластинами из никелированного железа или нержавеющей стали в растворе едкого кали или едкого натра. При прохождении через такой противоэлемент тока происходит реакция электролиза воды с выделением водорода на катоде и кислорода на аноде. Материал электродов в реакциях не участвует. [45]
Страницы: 1 2 3 4