Реакция - выделение - кислород
Cтраница 1
Реакция диодного выделения кислорода является основной реакцией при электролитическом получении кислорода, вспомогательной реакцией при производстве веществ, образующихся на клтаде, например, в гндро лекпю тал: у гни, и побочной реаьт. К а - и при выделении водоро-д, эта реакция протекает к воде их растворах без добавления специальных реагентов. Обратную реакцию катодного восстановления кислорода ( называемую также реакцией ионизации кислорода) используют в четаллоноздушных ХИТ и в топливных элементах. Она играет значительную роль при коррозии металлов. [1]
Протекание реакции выделения кислорода в результате окисления на аноде ионов ОН - приводит к подавлению реакции окисления анионов ацетата и хлората, уменьшению доли тока на образование этана и перхлората натрия и падению их выходов. [2]
Поляризационные кривые для реакции выделения кислорода более сложные, чем для выделения водорода. Обычно наблюдаются несколько тафелевских участков с разными наклонами. В области средних плотностей тока коэффициент наклона Ъ этих участков очень близок к 0 12 В, а в области малых плотностей тока он иногда уменьшается до 0 06 В. [3]
Недостаток прямой информации относительно реакции выделения кислорода дает широкий простор для построения различных гипотез. [4]
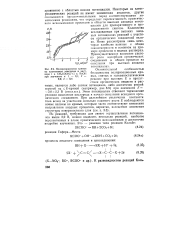 |
Поляризационные кривые на платиновом электроде в растворе 1 н. CHaCOONa л. н. NaOH при значениях х. 1 - 0 1. 2 - 0 2. 3 - 0 4. [5] |
Этим потенциалам отвечают торможение реакции выделения кислорода и начало окисления исходного органического соединения. [6]
Аналогичная картина наблюдается и для реакции выделения кислорода ( табл. 2), а также адсорбции с дегидрированием и электроокисления метанола. [8]
Двуокись свинца рассматривается как катализатор реакции выделения кислорода. Рекомбинация промежуточных соединений на поверхности РЬО2 вызывает разрыхление пленки двуокиси, что облегчает растворение свинца под пленкой. Известным подтверждением влияния каталитических реакций на анодную коррозию свинца может служить наличие в продуктах анодного окисления некоторых перекисных соединении ( например H2S2OB), а также влияние освещенности на скорость анодного окисления свинца. [9]
Это непосредственно доказывает наличие торможений для реакции выделения кислорода на высших окислах платины. [10]
Для целей кулонометрии может успешно применяться реакция выделения кислорода из перекисного кобальтового комплекса ( NH3) 5CoO2Co ( NH3) 55 - При этом на 1 F выделяется 1 25 г-экв кислорода. [11]
Это непосредственно доказывает наличие торможений для реакции выделения кислорода на высших окислах платины. [12]
Следовательно, указанные ионы селективно влияют на реакцию выделения кислорода на платиновом аноде, тормозя ее и снижая долю тока, расходуемую на эту побочную реакцию. Любопытно, что ионы С1 - при окислении серной кислоты на родиевом и иридиевом анодах не только повышают перенапряжение кислорода, как это наблюдается на платиновом аноде, но и влияют на скорость образования пероксодвусерной кислоты. Например, на иридиевом аноде скорость ее образования в присутствии ионов С1 - возрастает в 15 раз, а скорость реакции выделения кислорода уменьшается в 6 раз. Специфическое влияние ионов С1 - связывается с включением этих разрядившихся ионов в поверхностный слой электрода, что улучшает адсорбционные свойства родия и иридия, способствует созданию высоких поверхностных концентраций радикалов HSO4 и протеканию электросинтеза кислоты по оптимальному для этой реакции механизму электрохимической десорбции. [13]
Следовательно, указанные галоген-ионы селективно влияют на реакцию выделения кислорода, тормозя ее и снижая долю тока на эту побочную реакцию. [14]
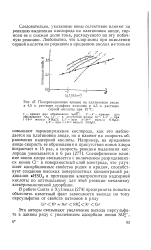 |
Поляризационные кривые на платиновом аноде. [15] |
Страницы: 1 2 3 4