Реакция - выделение - кислород
Cтраница 3
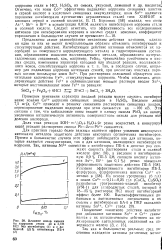 |
Влияние иоиов никеля на коррозию стали 40 в 3 7М НС1 без ингибитора ( / и с добавкой 0 5 % ингибитора ПБ-4 ( 2. [31] |
Эта связано с тем, что кобальтовые ионы входят в пленку окисла РЬО2 на аноде, увеличивая каталитическую активность поверхностного окисла для реакции выделения кислорода. [32]
Таким образом, можно считать, что на аноде протекают параллельно реакции ( 1) и ( 3), которым сопутствует также реакция выделения кислорода. [33]
Заметим, что в поверхностных слоях титана с большей концентрацией палладия формируются окисные пленки с более высоким содержанием палладия, чем в обедненных, что объясняется увеличением скорости реакции выделения кислорода. При этом плотность анодного выделения кислорода при 373 К имеет тенденцию к стабилизации. [34]
То обстоятельство, что перед началом анодной активации металла в растворе NaClOa через систему протекает сравнительно высокая плотность тока i ( 1 - 5 а / см2) за счет реакции выделения кислорода ( в отличие от активации железа ионами С1 - и С1О4 -), является очень благоприятным фактором для ЭХРО. Протекание некоторого тока на тех участках обрабатываемой детали, которые не предназначены для обработки, за счет рассеивания тока в электролите в рассматриваемом случае не вызывает растворения металла на этих участках. Это обеспечивает высокую локализацию процесса растворения металла в зоне обработки и высокую точность ЭХРО. Кроме того, качество поверхности деталей из ряда металлов и сплавов, обработанных в растворах NaClOs, часто бывает более высоким, чем в растворах других электролитов. [36]
Таким образом, кинетика этой реакции каталазы с перекисью в широком интервале концентраций очень сложна, и задача состоит в решении вопроса о том, какова же по существу кинетика реакции выделения кислорода неразрушенным энзимом. Большую часть своих опытов они проводили, используя концентрации перекиси, равные 0 1 М или меньшие, при которых Джордж также обнаружил прямую пропорциональность между начальной скоростью и концентрацией перекиси. При более высоких концентрациях перекиси, равных 0 3 и 1 0 Ж, Милликен и Мак-Лафлин ( см. [64]) не обнаружили, в противоположность результатам Джорджа, никакого уменьшения скорости. Для решения этого вопроса необходимы дальнейшие экспериментальные исследования в этом интервале концентраций. [37]
Однако условия в живой клетке могут стабилизировать окисленную форму или сделать менее опасной ее неустойчивость, обеспечивая быстрое возвращение к восстановленному окрашенному состоянию всех молекул оСЫ, которые не используются в реакции выделения кислорода. СЫХ, в живой клетке идет очень быстро, так как оба продукта остаются в связи с комплексом. [38]
Бифункциональный электрод кроме гидрофобного и активного слоев имеет гидрофильный, обычно никелевый, слой ( слой 4 на рис. 4.8, б), обращенный к раствору щелочи и каталитически активный в реакции выделения кислорода. В гидрофильном слое выделяется кислород при заряде ЭА. Активный слой воздушного электрода при этом не работает. [39]
Фоторадиационный эффект Эфр стимулирует катодный процесс металлов, образующих окислы / 7-типа ( Си, Ni, Сг), и, наоборот, замедляет коррозию металлов с оксидами - типа, снижая перенапряжение реакции выделения кислорода. Обычно этот эффект перекрывается Эдс. [40]
При электролизе хлоридных растворов, как уже указано, наряду с реакциями выделения кислорода, возможно протекание реакции выделения хлора (3.7), стандартный потенциал которой ( 1 359 В) более положителен, чем реакций выделения кислорода. Исходя из этого, казалось бы, что основным процессом при электролизе должно быть выделение кислорода, но вследствие высокого кислородного перенапряжения на многих металлах в основном происходит выделение хлора. [41]
Цинк получают электролизом кислых растворов очищенного сульфата цинка, используя листовые алюминиевые катоды и аноды из чистого свинца. На аноде протекает реакция выделения кислорода из раствора, и вследствие этого концентрация серной кислоты в растворе непрерывно увеличивается; для корректировки кислотности циркулирующий раствор подщелачивают. [42]
В таблице приведены количество СО, окисленное в каждом опыте, количество кислорода, удаленное из образца в результате стехиометрической реакции, и вес кислорода, требующегося для окисления окиси углерода. Приводятся два пути реакции выделения кислорода из соли серебра. Путь Б находится в более близком соответствии с фактическим весовым количеством кислорода, затраченным каждым образцом на реакцию с окисью углерода; как подтвердили результаты химических анализов, он также более правдоподобно представляет образование твердых продуктов. [43]
Кислородные реакции наблюдаются при потенциалах, при которых поверхность большинства металлов покрыта адсорбционными или фазовым. Это особенно относится к реакции выделения кислорода, которая протекает в области потенциалов 1 5 - - 2 2 В ( о. Многие металлы при чтнх потенциалах растворкютс или полностью окисляются. [44]
Проводились сравнительные исследования в направлении повышения селективности и увеличения стабильности электродных систем на основе оксидов титана, рутения, марганца с применением современных методов исследования SEM, СТМ, РФА и др. Проведено изучение формирования селективных систем на подложках из оксидов рутения, титана, олова. При формировании селективных к реакции выделения кислорода электродов на основе комбинированной гальвано-пиролитической технологии в активное покрытие кроме основного компонента - диоксида марганца введены оксиды кобальта, что позволило увеличить селективность на 1 % и повысить стабильность анода при электролизе разбавленных хлоридных растворов. На наноуровне методом сканирующей электронной спектроскопии ( СТМ) выявлены изменения морфологии подслоя из оксидов рутения и титана за счет введения в нее дополнительно оксида олова. В целом, как изменение состава подслоя, так и активного слоя способствуют повышению селективных свойств электродов и их стабильности. [45]
Страницы: 1 2 3 4