Реакция - выделение - водород
Cтраница 1
Реакции выделения водорода и кислорода зависят от рН и протекают с участием электронов, на диаграмме это линии в и г, а реакция Fe - vFe2 2e соответствует линии а. Линии диаграммы ограничивают области, определяющие термодинамическую стабильность или нестабильность металла при различных рН растворов и электродных потенциалах металла. [1]
Реакция выделения водорода по второй схеме протекает при больших скоростях и соответственно более высоких значениях катодного потенциала. Вследствие большой концентрации воды в растворе предельный ток весьма велик, и процесс описывается уравнением Тафеля в очень широком диапазоне катодных плотностей тока. [3]
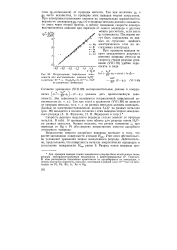 |
Исправленные тафелевские зависимости для восстановления анионов S2Ojj - в растворе Ю-3 н. Na2S2O8 9 - Ю 3 н. NaF. [4] |
Скорость реакции выделения водорода сильно зависит от природы металла. В табл. 14 приведены токи обмена для разряда ионов Н3О на разных металлах. Можно показать, что резкое изменение / 0 при переходе от Hg к Pt обусловлено возрастанием энергии адсорбции атомарного водорода. [5]
Так как реакции выделения водорода и кислорода зависят от рН и протекают с участием электронов, то они обе представлены наклонными линиями, обозначенными на фиг. [6]
Рассмотрим кинетику реакции выделения водорода в общем виде, так чтобы полученные уравнения описывали поведение системы при средних значениях степени заполнения, когда предпочтительными оказываются условия Темкина. [7]
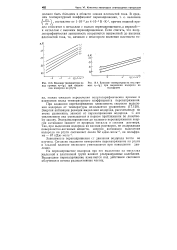 |
Влияние температуры на ход прямых г - lg / при выделении водорода на ртути.| Влияние температуры на ход прямых 11 - lg / при выделении водорода на вольфраме. [8] |
Энергия активации реакции выделения водорода, рассчитанная по этому уравнению, зависит от перенапряжения водорода. С его увеличением она уменьшается в первом приближении по линейному закону. [9]
Критерием протекания реакции выделения водорода могла бы быть величина Ьк, так как, согласно расчетам, она должна быть различна для разных механизмов. [10]
Кинетические параметры реакции выделения водорода при коррозии железа в хлоридных растворах отличаются от параметров, характеризующих процесс в сульфатных средах ( табл. 2.1 и 2.2), что связано с влиянием адсорбции анионов. [11]
Увеличение поляризации реакции выделения водорода достигается, в основном, введением различных поверхностно-активных добавок в электролит, как нейтральных, так и катионных. Применяют и другие способы. [12]
Явление перенапряжения реакции выделения водорода достаточно полно описывается уравнениями автоэлектронной эмиссии электронов с учетом туннелирования через потенциальный барьер в виде ДЭС, позволяющими произвести расчет таких важных характеристик кинетики электродных реакций, как токи обмена, энергии активации процесса. [13]
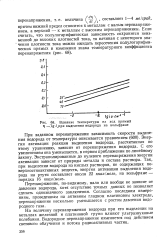 |
Влияние температуры на ход прямых т - lg при выделении водорода на вольфраме. [14] |
Энергия активации реакции выделения водорода, рассчитанная по этому уравнению, зависит от перенапряжения водорода. С его увеличением она уменьшается, в первом приближении по линейному закону. [15]
Страницы: 1 2 3 4