Реакция - выделение - водород
Cтраница 3
Состав раствора электролита влияет на скорость реакции выделения водорода не только через концентрацию разряжающихся частиц, но и косвенно, через строение двойного электрического слоя, в частности, через значение - - потенциала. [31]
Ряд кинетических закономерностей, связанных с реакцией выделения водорода на отдельных электродах, можно считать хорошо установленными. К их числу относится, например, зависимость потенциала электрода или величины перенапряжения реакции от плотности поляризующего тока, зависимость перенапряжения от температуры и другие. Эти вопросы изучены и решены также для ряда других реакций. [32]
Кинг и Миллер считают [3], что реакция выделения водорода происходит на сульфиде железа, который, в свою очередь, образуется в результате реакции иона Fe2 с сульфид-ионом, выделяемым бактериями. [33]
 |
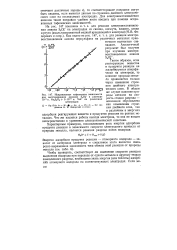
Поляризационные кривые для реакции выделения водорода на различных металлах из кислых растворов. [34] |
На рис. 19.1 приведены поляризационные кривые для реакции выделения водорода из кислых растворов электролитов на электродах из разных металлов. Результаты поляризационных измерений очень чувствительны к условиям опыта, в частности, к степени чистоты поверхности электрода и раствора; по этой причине данные разных авторов заметно расходятся. [35]
 |
Исправленные тафелевские зависимости. [36] |
Чтобы проверить, соответствует ли изменение скорости реакции выделения водорода при переходе от одного металла к другому теории замедленного разряда, необходимо знать энергии ( или теплоты) адсорбции атомарного водорода на соответствующих электродах. [37]
Они отмечают также, что при проведении реакции выделения водорода и образования продуктов восстановления альдегида не наблюдалось. [38]
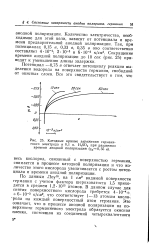 |
Катодные кривые заряжения германиевого электрода в 0 1 н. H2SO4 при различном времени анодной поляризации ( - fa0 35 в. [39] |
Потенциал - 0 75 в отвечает потенциалу реакции выделения водорода на поверхности германия, свободной от окисных слоев. [40]
В табл. 48 приведены величины, характеризующие реакцию выделения водорода для различных возможных путей ее протекания, когда источником протона является гидроксониевый ион. Причем О обозначает долю поверхности, покрытую водородом, a v - стехио-метрическое число. Как следует из табл. 47 - ( дч ] / д п i) IRTjF и vl для р-германиевого электрода, у которого потенциал погружения соответствует, no - существу, перенапряжению, равному нулю. Сравнение этих данных с данными табл. 48 показывает, что наклон тафелевской кривой почти исключает случай такого электрода, который обладает высокой плотностью поверхностных ионизованных состояний. [41]
В табл. 48 приведены величины, характеризующие реакцию выделения водорода для различных возможных путей ее протекания, когда источником протона является гидроксониевый ион. Причем § обозначает долю поверхности, покрытую водородом, a v - стехио-метрическое число. Как следует из табл. 47 - ( dfi / dlni) 2RT / F и v 1 для р-германиевого электрода, у которого потенциал погружения соответствует, no - существу, перенапряжению, равному нулю. Сравнение этих данных с данными табл. 48 показывает, что наклон тафелевской кривой почти исключает случай такого электрода, который обладает высокой плотностью поверхностных ионизованных состояний. [42]
Проблема выделения металла без сопутствующей ( параллельной) реакции выделения водорода может быть решена, если использовать растворители, обладающие более высокой электрохимической устойчивостью, чем вода. [43]
Полученные до настоящего времени значения dr / dlnic реакции выделения водорода группировались [4] около величин наклона кривых ( при 25), равных: 0 12; 0 04; 0 03, причем эти величины наклона тафелевских кривых связывались с определенными механизмами. [44]
При отсутствии этих ограничений в большинстве случаев скорость реакции выделения водорода лимитируется либо скоростью реакции разряда, либо скоростью реакции рекомбинации или электрохимической десорбции. [45]
Страницы: 1 2 3 4