Реакция - катодное выделение - водород
Cтраница 3
ФАК на энергию связи металл - водород, Во всяком случае, этот дополнительный эффект должен быть достаточно большим, чтобы перекрыть то ускорение реакции катодного выделения водорода, которое должно было бы наблюдаться за счет появления отрицательного - потенциала при адсорбции ФАК. [31]
В течение длительного времени H / D-изотопный эффект использовался в изучении кинетики и механизма процессов переноса протона и таким образом служил важным источником информации о механизме реакции катодного выделения водорода на разных металлах. [32]
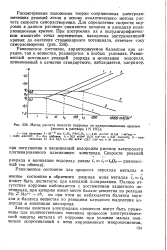 |
Метод расчета скорости коррозии по поляризационным кривым ( железо в растворе 1 N НСЦ. [33] |
Полное отсутствие коррозии наблюдается с достижением защитного потенциала, при котором имеет место баланс вещества по реакции Me Мел 8, но при этом не наблюдается баланса зарядов и баланса вещества по реакциям катодного выделения водорода и ионизации кислорода. [34]
Реакор-11 ЮА, Реакор-11 ЮСП, СПМ-1 и СПМ-2 в кислых сероводородсодержащих минерализованных средах обусловлен хемосорбци-ей их молекул на металлической поверхности, образованием ионной связи между катионами железа и комплексными ионами, содержащими никель и цинк, а также инверсионным воздействием ингибиторов на контролирующую стадию реакции катодного выделения водорода. [35]
 |
Области с различными. [36] |
При обсуждении закономерностей многостадийных процессов предполагалось, что заполнение поверхности промежуточными продуктами реакции мало и его можно не учитывать. Анализ реакции катодного выделения водорода на различных металлах указывает на необходимость учета заполнения поверхности адсорбированным водородом. Это приводит к существенному усложнению кинетических соотношений. [37]
Такая полулогарифмическая поляризационная зависимость была впервые установлена в 1905 г. И. Тафелем для реакции катодного выделения водорода на ряде металлических электродов и известна в электрохимической литературе как уравнение Тафеля. [38]
Очевидно, что при изменении величин х ( число молекул воды, участвующих в реакции) и z ( количество электронов, принимаемых в электрохимической стадии) будут изменяться п и Ьк - Величина п может приобретать, в частности, нецелочисленйые значения. Дробные порядки реакции катодного выделения водорода возможны и в случае одновременного протекания процесса по нескольким параллельным маршрутам. [39]
Настоящее исследование посвящено влиянию последних на удельную адсорбционную и электрохимическую активность единицы поверхности платиновых катализаторов. В качестве модельных использованы реакции катодного выделения водорода, анодного выделения кислорода, анодного окисления метанола, хемосорбции кислорода, анионов и метанола. Все приведенные в этой работе значения констант скоростей пересчитаны на единицу истинной поверхности или на один поверхностный атом платины. [41]
Допущение того, что выделение металла совершается не как последовательная стадийная реакция, а как один элементарный акт, противоречит всем результатам, полученным при изучении кинетики различных электрохимических процессов. Если бы его применить, например, к реакции катодного выделения водорода, пришлось бы принять, что водородное перенапряжение не зависит от природы катода и энергетические изменения в ходе реакции всегда отвечают равновесному водородному электроду. Это не соответствует действительности. Чтобы объяснить связь, существующую между перенапряжением и природой металла, а также между величиной перенапряжения и составом раствора, необходимо, по-видимому, исходить не только из конечного и начального состояний металлических ионов, но и из природы элементарных актов. При этом следует учитывать и свойства реагирующих частиц на различных стадиях суммарного процесса. [42]
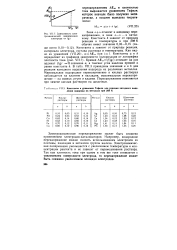 |
Зависимость электрохимической поляризации электрода от lg i.| Константы в уравнении Тафеля для реакции катодного выделения водорода на металлах при 298 К. [43] |
Константа а зависит от природы реакции, материала электрода, состава раствора и температуры. В табл. VII.3 приведены значения а и b для реакции катодного выделения водорода на различных металлах. Минимальное водородное перенапряжение в кислых растворах наблюдается на платине и палладии, максимальное перенапряжение - на свинце, ртути и кадмии. Перенапряжение изменяется при замене кислых растворов на щелочные. [44]
Электрохимические реакции, как правило, имеют довольно сложную природу. Это относится даже к таким на первый взгляд простым реакциям, как реакции катодного выделения водорода или катодного восстановления молекулярного кислорода. Как показывают многочисленные исследования, такая сложность обусловлена большим числом промежуточных стадий, сопровождающих процесс электрохимического превращения. В этих реакциях сочетаются химические стадии, протекающие по обычным законам химической кинетики, и электрохимические стадии, в которых проявляются своеобразные специфические закономерности. Скорость электрохимических реакций зависит от большого числа факторов ( материал электрода, природа раствора электролита, температура, величина потенциала электрода и др.) влияющих на всю реакцию в целом или на отдельные ее стадии. [45]
Страницы: 1 2 3 4
