Реакция - водяной газ
Cтраница 1
Реакция водяного газа с газовой смесью 1GO: 1Н20 проводилась при разных температурах на катализаторе, предварительно использованном в синтезе в течение 100 час. [2]
 |
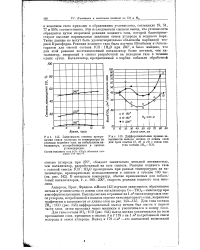
Схема газогенератора.| Конверсия метана с водяным паром ( кривые а и конверсии СО ( кривые б. - 26 а / га, - - - 16 am. соотношение водяной пар. метан в сырьевом потоке. [3] |
Реакция водяного газа [ уравнение ( 22) ] не зависит от давления, но протеканию ее способствует низкая температура и высокое отношение водяной пар: газ. Высокое отношение реагентов необходимо и для того, чтобы предотвратить отложение углерода на катализаторе. [4]
Реакция водяного газа СО Н2О СО2 Н2 протекает с заметной скоростью в присутствии твердого катализатора, который соответствующим образом деформирует адсорбированные на нем молекулы газов. При некоторых условиях она осуществляется и как гомогенная. Согласно Кондратьеву [99], такое взаимодействие СО и Н2О имеет место, например, в присутствии хотя бы следов кислорода. [5]
Поскольку реакция водяного газа течет с поглощением тепла, константа равновесия ее должна увеличиваться с повышением температуры. Другими словами, росту температуры отвечает увеличение содержания НаО, а понижению Т - повышение содержания СО2 в равновесной смеси газов. [6]
Сдвиг равновесия реакции водяного газа нарушает равновесие между продуктами крекинга метана. [7]
 |
Условия синтеза и выход продуктов синтеза углеводородов из СО и Н2О. [8] |
С идет лишь реакция водяного газа. Увеличение объемной скорости при атмосферном давлении уменьшает долю побочных реакций, однако одновременно снижается выход углеводородов. Найдено, что максимальная объемная скорость для получения 90 % - ной конверсии СО должна в 9 - 12 раз превышать рабочее давление. В отличие от синтеза Фишера-Тропша повышение общего давления приводит к увеличению производительности катализатора и ослаблению побочных реакций. [9]
Значения констант равновесия реакции водяного газа, применявшиеся при вычислениях, были следующие: 0 0143 при 283, 0 0217 при 810, 0 054 при 380 и 0 105 при 444 С. [10]
При высоких соотношениях - реакция водяного газа практически отсутствует, а при низких соотношениях проявляется наиболее интенсивно. [11]
Повышение температуры смещает равновесие реакции водяного газа в сторону образования окиси углерода и воды. Однако угол наклона кривой К - f ( T) для этой реакции с ростом температуры уменьшается, тем самым влияние ее на изменение содержания СО, СО2 и Н2 становится малозначительным. Проведенное нами сравнение содержания СО, СОз, Н2 и Н2О, получаемых при экспериментах, с расчетным составом по реакции водяного газа, соответствующим равновесному при температурах опытов, подтверждает фактически имеющее место равновесное содержание указанных компонентов. Представленная нами табл. 3 и рисунки позволяют судить также об изменениях состава реакционного газа и выхода СО в зависимости от отношения газа к кислороду в исходной смеси. При уменьшении этого соотношения концентрация двуокиси углерода заметно растет, а концентрация окиси углерода и водорода в конечном газе уменьшается. Влияние добавки кислорода на содержание метана в конечном газе, в условиях наших опытов, менее заметно. [12]
Реакция конверсии окиси углерода или реакция водяного газа ( третья) при обычных температурах идет с выделением тепла. [13]
При температуре выше 1000 равновесие реакции водяного газа устанавливается необычайно быстро. Так, еще Габер [3] показал, что уже в непосредственной близости от внутреннего конуса бунзеновской горелки состав газа соответствует равновесию водяного газа. [14]
Это означает, что ускорение реакции водяного газа углем и отсутствие торможения реакции газификации окисью углерода ( и, возможно, водородом) не должны противоречить друг другу. [15]
Страницы: 1 2 3 4