Реакция - щелочной гидролиз
Cтраница 2
Исследованы кинетические закономерности реакции щелочного гидролиза 4 4 / - дихлордифенилсульфона в среде диметилсульфоксид - вода. Найдены порядки реакции по отдельным компонентам. Исследовано влияние состава растворителя на скорость реакции. [16]
Исследованы кинетические закономерности реакции щелочного гидролиза 4 4 -ди-хлордифенилсульфона в среде диметилсульфоксид - вода. Найдены порядки реакции по отдельным компонентам. Исследовано влияние состава растворителя на скорость реакции. [17]
Исследованы кинетические закономерности реакции щелочного гидролиза 4 4 -дихлордифенилсульфона в среде диметилсульфоксид - вода. Найдены порядки реакции по отдельным компонентам. Исследовано влияние состава растворителя на скорость реакции. [18]
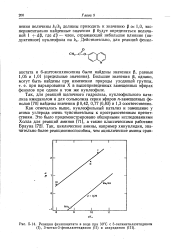 |
Реакции фенилацетата в воде при 30 С с 3-оксиметилазетидином ( I, З - метил-3 - фенилазетидином ( II и азиридином ( III. [19] |
Так, для реакций щелочного гидролиза, нуклеофильного катализа имидазолом и для сольволиза серии эфиров n - замещенных фенолов [70] найдены значения 0 0 42, 0 77 ( 0 83) и 1 3 соответственно. [20]
Это подтверждает, что реакция щелочного гидролиза ИПХА описывается уравнением второго порядка. [21]
Таким образом, в реакции щелочного гидролиза нитрильной группы наименее реакционноспособным является изомер 1 2 -, как в случае этиль-ного, так и в случае фенильного заместителя. В нитрилах изомерных этилферроценкарбоновых кислот индуктивный и пространственный эффекты этильного остатка действуют в одну сторону и приводят к значительной дезактивации CN-группы в соседнем положении. В случае нитрилов фенилферроценкарбоновых кислот пространственный и отрицательный индукционный эффекты фенильного заместителя направлены в противоположные стороны, при этом, очевидно, пространственные препятствия играют основную роль. [22]
Задание 10.5. Напишите схему реакции щелочного гидролиза полно - iO метилового эфира яблочной ( гидроксибутандиовон) кислоты. [23]
Говоря о каталитическом характере реакций щелочного гидролиза производных кислот фосфора или производных карбоновых кислот, по-видимому, можно рассматривать гидроксильные ионы как компоненты нуклеофильного 16 ] или общеосновного катализа [6, 258] ( см. также [6, 7]), и поэтому рассмотренный в предыдущем разделе щелочной гидролиз фосфорсодержащих соединений может быть также отнесен к каталитическим реакциям. [24]
Дихлорметильная группа малоактивна в реакциях щелочного гидролиза. [25]
Использование метилового спирта в качестве среды для реакции щелочного гидролиза гексахлорбензола требует применения высоких давлений ( 10 - 15 атм), что в известной мере усложняет оборудование. Поэтому в качестве среды для реакции более целесообразно использовать спирты с высокой температурой кипения. Для этих целей могли бы быть применены высшие одноатомные спирты, как апример изоамиловый и другие. В связи с этим более приемлемыми являются многоатомные спирты, например этиленгликоль ( температура кипения 197 С) - Применение этиленгликоля позволяет вести процесс при невысоком или даже атмосферном давлении. Достоинство этиленгликоля заключается также в его почти полной инертности по отношению к щелочам даже при температуре 160 - 165 С. [26]
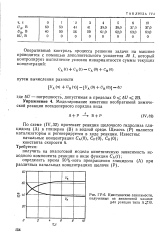 |
Кинетические зависимости. [27] |
По схеме ( IV, 32) протекает реакция щелочного гидролиза гли-цидола ( А) в глицерин ( В) в водной среде. Щелочь ( Р) является катализатором и регенерируется в ходе реакции. [28]
Таким образом, отношение скоростей обратной и прямой реакций нормального щелочного гидролиза и гидролиза, катализируемого Си ( II), является практически одинаковым. [29]
Киндлер [16] впервые подробно изучил влияние заместителей на скорость реакции щелочного гидролиза второго порядка сложных эфиров R COOR, в которых R или R представляют собой фенильные или замещенные фениль-ные группы. Исследования Киндлера были продолжены Натаном и автором этой книги [17], Эвансом, Гордоном и Уотсоном [18], а также Томмила и Хин-шелвудом [19] главным образом с целью изучения температурного коэффициента реакции и констант Аррениуса. При этом было найдено, что такие заместители, как СН3, ОСН3 в тгара-положении и NH2, замедляют абсолютную скорость реакции, а галогены и группа N02 ускоряют ее. Следует отметить, что группа NH2, если она находится в / гора-положении в R, замедляет реакцию сильнее, чем если она находится в жетоа-положении в R или в иа / а-положении в R. Сильное влияние этой группы, находящейся в иара-положении в R, несомненно должно быть приписано сопряжению между амино - и карбоксильной группами через ароматическое кольцо. [30]
Страницы: 1 2 3 4