Реакция - деалкилирование
Cтраница 2
Так как реакция деалкилирования фенильных производных германия происходит при более низкой температуре, то ее с успехом можно вести в открытых сосудах. [16]
На основе реакций деалкилирования и диспропорционирова-ния разработаны способы получения изомерных моно-грег-бу-тилфенолов. Согласно патенту59, о-грег-алкилфенолы, в частности о-грег-бутилфенол, могут быть превращены в п-грег-алкил-фенолы в двухступенчатом процессе. В первой ступени о-грег-бутилфенол алкилируется с образованием 2 4-ди-грет - бутилфе-нола. [17]
Для протекания реакции деалкилирования требуется более высокая температура, чем для реакции диспропорционирования алкилфенолов, что связано в первом случае с полным отщеплением алкильной группы и последующей стабилизацией отщепившейся частицы путем, присоединения водорода. При диспропорционировании полный отрыв этой группы не является необходимым, так как эта реакция может осуществляться путем синхронной передачи алкильной группы. [18]
Что касается реакций деалкилирования ( деарилирования) триалкил ( арил) - висмута, то они проводились в основном с целью исследования прочности связи висмута с углеродом по отношению к различным реагентам. Для применения этих реакций в синтетических целях требуются, по-видимому, дополнительные исследования. [19]
Трудность проведения реакции деалкилирования обусловлена природой алкильных замещающих групп, связанных с нафталиновым ядром. Как было показано в предыдущих разделах, среди алкильных групп преобладают метальные; деметилирование же, как известно, представляет собой наиболее трудно осуществляемую реакцию деалкилирования. [20]
Относительные скорости реакций деалкилирования указанных фенолов изменяются в зависимости от температуры. С повышением степени превращения фенолов уменьшалось различие в их относительных скоростях, но сохранялся ряд их активности: - грег-бутилфенол п-трет-октилфенол 2-фенил - 2 - ( п-оксифенил) - пропан 2 2-ди - ( - оксифенил) - пропан. [21]
При проведении реакции деалкилирования дибутилового эфира винил-фосфинистой кислоты бромистым или хлористым водородом в эфире при 0 и уксусной кислотой ( сильное разогревание после смешения) 1 получены только полимерные продукты. [22]
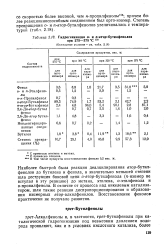 |
Гидрогенизация о - и п-вгор-бутилфенолов при 275 - 375 С 15в. [23] |
Наиболее быстрой была реакция деалкилирования втор-бутил-фенолов до бутилена и фенола, в значительно меньшей степени шла деструкция боковой цепи о-втор-бутилфенола ( n - изомер не вступал в эту реакцию) до метана, этилена, о-этилфенола и о-пропилфенола. [24]
Как уже указывалось, реакция деалкилирования по лных эфиров фосфористой кислоты лежит в основе ряда важнейших методов синтеза диалкилфосфитов. Кроме методов деалкилирования триалкилфосфитов и, соответственно, деарилирования триарилфосфитов, к этой же группе по химизму реакции следует отнести и основной способ получения диалкилфосфитов, заключающийся во взаимодействии треххлористого фосфора со спиртами. [25]
Цикланы и арены претерпевают реакции деалкилирования алкильных цепей, образуя алканы, алкены и цикланы с короткой боковой цепью. Шестичленные цикланы дегидрируются в арены, а последние подвергаются поликонденсации, образуя высокомолекулярные жидкие продукты. [26]
Цикланы и арены претерпевают реакции деалкилирования алкиль-ных цепей, образуя алканы, алкены и цикланы с короткой боковой цепью. Шестичленные цикланы дегидрируются в арены, а последние подвергаются поликонденсации, образуя высокомолекулярные жидкие продукты. [27]
Как уже указывалось, реакция деалкилирования полных эфиров фосфористой кислоты лежит в основе ряда важнейших методов синтеза диалкилфосфитов. Кроме методов деалкилирования триалкилфосфитов и, соответственно, деарилирования триарилфосфитов, к этой же группе по химизму реакции следует отнести и основной способ получения диалкилфосфитов, заключающийся во взаимодействии треххлористого фосфора со спиртами. [28]
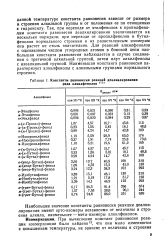 |
Константы равновесия реакций деалкилирования ряда алкилфенолов - 13. [29] |
Наибольшее значение константы равновесия реакции деалкилирования имеют орто-изомеры независимо от величины и строения алкила, наименьшее - мета-изомеры алкилфенолов. [30]
Страницы: 1 2 3 4