Любая реакция
Cтраница 1
Любая реакция может протекать самопроизвольно только в направлении, приближающем систему к состоянию равновесия. [1]
Любая реакция может пойти, если будет выполнен энергетический баланс: энергии исходных частиц должно быть достаточно для образования конечных и придания им движения в соответствии с законом сохранения импульса. [2]
 |
Примеры симметрического и асимметрического синтезов 4 - 266. [3] |
Любая реакция, в которой хиральная молекула получается из полностью ахирального или рацемического исходного материала, дает равные количества обоих энантиомеров. Например, в реакции бутанона с LiAlH4 ( рис. 2.24, а) нуклеофильный ион А1Н4 - может атаковать молекулу с равной вероятностью с любой стороны, и образуются в равных количествах оба энантио-мера. Однако если одно из исходных соединений уже хирально, то два сорта молекул продукта реакции ( диастереомеры) получаются в неравных количествах ( рис. 2.24 6), поскольку два переходных состояния, приводящие к продуктам, уже не идентичны. Такие реакции называются асимметрическим синтезом. [4]
 |
Изменение изобарного потенциала по мере протекания процесса ( схема. [5] |
Любая реакция может протекать самопроизвольно только в направлении, приближающем систему к состоянию равновесия. [6]
Любая реакция с участием соседней группы, протекающая через симметричный мостиковый катион, должна давать в числе других и перегруппированные продукты. В случае R1 R2 R3 всегда можно установить наличие структурной перегруппировки по продуктам реакции, в то время как для замещения по Ср стереохимический критерий здесь уже отсутствует. [7]
Любая реакция между газообразными веществами, которая протекает на поверхности катализатора, может быть расчленена на пять последовательных стадий: 1) подвод вещества к поверхности катализатора; 2) адсорбция вещества; 3) реакция на поверхности катализатора; 4) десорбция продукта реакции с поверхности катализатора; 5) отвод продуктов реакции от поверхности в объем газовой фазы. Общая скорость процесса определяется наиболее медленной его стадией. [8]
Любая реакция, кото -: рая может быть выполнена обычным титрованием, может быть применена для потенциометрических целей, если при этом мы располагаем подходящим ичдакаторным электродом. Электроды, пригодные для измерения рП, могут быть использованы во всех случаях определения кислотности или щелочности ( см. стр. В отношении определения титрованием ионов металлов мы ограничены в выборе. Металлы, стоящие в ряду напряжения выше водорода, легко окисляются и поляризуются, и поэтому не пригодны при потенциометрическом титровании. [9]
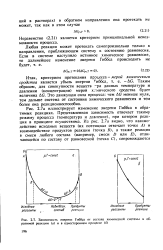 |
Зависимость энергии Гиббса от состава химической системы в обратимой реакции ( а и в одностороннем процессе ( б. [10] |
Любая реакция может протекать самопроизвольно только в направлении, приближающем систему к состоянию равновесия. [11]
Любая реакция обязательно сопровождается рассеянием. [12]
Любая реакция, включающая в качестве промежуточного соединения я-комплекс, может идти также через классический карбониевый ион, поскольку я-комплексы можно рассматривать как изомерные формы карбониевых ионов [ ср. Рассмотрим факторы, которые, как можно полагать, определяют этот выбор. [13]
Любая реакция между газообразными веществами, протекающая на поверхности катализатора, может быть расчленена на пять последовательных стадий: 1) подвод вещества к поверхности катализатора; 2) адсорбция его; 3) реакция на поверхности; 4) десорбция продуктов реакции с поверхности; 5) отвод продуктов реакции от поверхности в объем газовой фазы. Общая скорость процесса определяется наиболее медленной его стадией. [14]
Любая реакция между газообразными веществами, протекающая на поверхности катализатора; может быть расчленена на пять последовательных стадий: I) подвод вещества к поверхности катализатора; 2) адсорбция его; 3) реакция на поверхности; 4) десорбция продукта реакции с поверхности; 5) отвод продуктов реакции от поверхности в объем газовой фазы. Общая скорость процесса определяется наиболее медленной его стадией. [15]
Страницы: 1 2 3 4