Лимитирующая реакция
Cтраница 1
Лимитирующая реакция является реакцией первого порядка, следовательно, и общая реакция разложения 2N2O5 - реакция первого порядка. [1]
Лимитирующей реакцией, определяющей степень неравновесности течения, является реакция ОН Н А Н20 А. Выбор величины константы скорости этой реакции определяет точность расчета процесса рекомбинации в сопле. [2]
Катодной лимитирующей реакцией может быть разряд катиона, а анодной - отрыв электрона от пиридина, с вероятным образованием иона ( пиридил-2) пириднния. [3]
Восстановление воды как лимитирующая реакция приложима главным образом к металлам в щелочных растворах при высоких или низких плотностях тока. [4]
В растворах КТМА лимитирующей реакцией является окисление иона хлора, а в растворах Mg ( ClO4) 2 лимитирующая реакция сопровождается образованием на электроде непроводящей пленки. С этими данными примерно согласуются соответствующие данные Коки и Серве: предельный потенциал - 3 В относительно электрода Ag / AgCl для растворов LiClO4, Mg ( ClO4) 2 и ПТБА. [5]
Каталитической может стать и лимитирующая реакция цикла продолжения цепи. В стадии инициирования ионы Си2 не участвуют. Наблюдающееся разложение Н2О2 солями Си2 связано с микропримесями ионов железа в растворах. [6]
Как было показано, лимитирующей реакцией является восстановление катиона или растворение электронов. Эти растворы могут восстанавливать бензол и тетралин, что невозможно в ацетонитриле или диметилформамиде. Реакции протекают на платиновых, графитовых и углеродных катодах. Растворы, содержащие ИГБА, не окрашиваются в голубой цвет, однако восстановление тетралина происходит и в этом случае, хотя и с более низким выходом по току, чем в растворах LiCl. На основании этого, по-видимому, можно сделать некоторые выводы относительно значения потенциала, при котором растворение электронов становится существенным. [7]
Как было показано, лимитирующей реакцией является восстановление катиона или растворение электронов. Эти растворы могут восстанавливать бензол и тетралин, что невозможно в ацетонитриле или диметилформамиде. Реакции протекают на платиновых, графитовых и углеродных катодах. Растворы, содержащие ИТБА, не окрашиваются в голубой цвет, однако восстановление тетралина происходит и в этом случае, хотя и с более низким выходом по току, чем - в растворах LiCl. В растворах NH4C1 тетралин не восстанавливается. На основании этого, по-видимому, можно сделать некоторые выводы относительно значения потенциала, при котором растворение электронов становится существенным. [8]
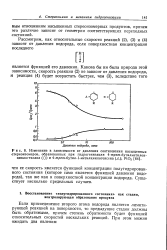 |
Изменение в зависимости от давления соотношения насыщенных. [9] |
Если присоединение второго атома водорода является лимитирующей реакцией на поверхности, то предыдущие стадии должны быть обратимыми, причем степень обратимости будет функцией относительных скоростей нескольких реакций. [10]
Для установления области рабочих потенциалов и природы лимитирующих реакций в этом растворителе Матер и Ансон [4] использовали хронопо-тенциометрию на платине. Они нашли, что кажущийся предельный потенциал в катодной области в растворах NaClO4 - НОАс - Ас2О близок к - 3 0 В относительно электрода Hg / Hg2 ( OAc) 2 и определяется восстановлением НОАс до газообразного водорода и ионов ацетата. В отсутствие НОАс кажущийся предель - ный потенциал близок к - 9 0 В. По их мнению, из этой величины не более 2 В обусловлены омическими потерями при измерениях. В этих условиях лимитирующей реакцией является восстановление натрия, который в дальнейшем реагирует с растворителем. [11]
Для установления области рабочих потенциалов и природы лимитирующих реакций в этом растворителе Матер и Ансон [4] использовали хронопотенциометрию на платине. Они нашли, что кажущийся предельный потенциал в катодной области в растворах NaClO4 - НОАс - Ас2О близок к - 3 0 В относительно электрода Hg / Hg2 ( OAc) 2 и определяется восстановлением НОАс до газообразного водорода и ионов ацетата. В отсутствие НОАс кажущийся предельный потенциал близок к - 9 0 В. По их мнению, из этой величины не более 2 В обусловлены омическими потерями при измерениях. В этих условиях лимитирующей реакцией является восстановление натрия, который в дальнейшем реагирует с растворителем. [12]
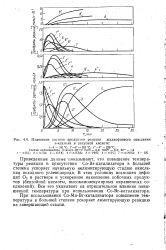 |
Изменение состава продуктов реакции жидкофазного окисления. [13] |
При использовании Со-Мп - Вг-катализатора повышение температуры в большей степени ускоряет лимитирующую реакцию на завершающей стадии. [14]
При высоких плотностях тока для многих металлов замедленная стадия разряда также является лимитирующей реакцией. [15]
Страницы: 1 2 3 4