Лимитирующая реакция
Cтраница 2
В растворах КТМА лимитирующей реакцией является окисление иона хлора, а в растворах Mg ( ClO4) 2 лимитирующая реакция сопровождается образованием на электроде непроводящей пленки. С этими данными примерно согласуются соответствующие данные Коки и Серве: предельный потенциал - 3 В относительно электрода Ag / AgCl для растворов LiClO4, Mg ( ClO4) 2 и ПТБА. [16]
Следует, однако, подчеркнуть, что указанный параллелизм может нарушаться, особенно в тех случаях, когда лимитирующей реакцией является не газификация углерода. [17]
Применение уравнений ( 49) и ( 50) для описания процесса восстановления окислов железа мало оправдано, тем более что лимитирующая реакция имеет нулевой порядок. [18]
Крайние значения Ев для октановой шкалы заключены в пределах 36 - - 16 ккал, практически совпадающих с крайними значениями энергии активации лимитирующих реакций двух типов холоднопламенного процесса. [19]
Если учесть, что реакция Н О2 - ЮН О является лимитирующей ( идет наиболее медленно, так как имеет наибольшую энергию активации Еакт 18 ккал / моль, в то время как энергия активации остальных реакций не превышает 10 ккал / моль), то легко видеть, что на одну лимитирующую реакцию приходится три реакции с выделением атомарного водорода, что и показано в приведенном уравнении. [20]
В целом по устойчивости к восстановлению ДМФ сравним с ацетонитрилом и диметилсульфоксидом, но обладает большей склонностью к процессам окисления. Лимитирующей реакцией при анодной поляризации с ртутным электродом является растворение, ртути. В случае платиновых электродов в перхлоратных растворах стабильность ограничивается реакцией окисления растворителя. Эта реакция, изученная О Доннеллом и Манном [9], а также Виско [3], включает стадию отрыва электрона от азота амида, за которой следует стадия потери протона с образованием радикала HCON ( CHs) CH2; последний далее реагирует на электроде или с другими компонентами системы. В растворах NaClO4 в ДМФ это приводит к образованию протонированного ДМФ, который способен восстанавливаться подобно кисло-ирте. [21]
В целом по устойчивости к восстановлению ДМФ сравним с ацетонитрилом и диме-тилсульфоксидом, но обладает большей склонностью к процессам окисления. Лимитирующей реакцией при анодной поляризации с ртутным электродом является растворение ртути. [22]
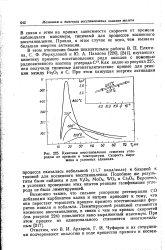 |
Кинетика восстановления гематита углеродом от времени и температуры. Скорость выражена в условных единицах. [23] |
Возможно также, что сильное ускорение регенерации СО добавками карбонатов калия и натрия приводит к тому, что она перестает тормозить процесс прямого восстановления ферритов никеля и кобальта. Лимитирующей реакцией становится косвенное восстановление, в связи с чем на кривых скоростей ( см. рисунок 224) появляется явно выраженный максимум. [24]
Скорость его определяется самым медленным этапом, который может задерживать все остальные и поэтому называется лимитирующим или определяющим. Скорость лимитирующей реакции может зависеть от концентраций этилена и водорода не так, как это требует указанное соотношение. [25]
На КРЭ был достигнут максимальный катодный потенциал - 0 835 В относительно стационарного ртутного электрода. По-видимому, лимитирующая реакция включает разряд ионов водорода. Анодная реакция на стационарном ртутном электроде приводит к образованию нерастворимого метансульфоната одновалентной ртути. [26]
Хотя струйные методы позволяют проводить измерения при длительности реакции порядка миллисекунд, а не секунд, все же значительное число важных реакций не удается непосредственно исследовать этим методом и они нуждаются в еще более быстрой технике измерения. Даже медленные лимитирующие реакции в области максимальных скоростей процесса оказываются слишком быстрыми для измерений струйными методами. Помимо того, хотя скорость бимолекулярных стадий можно регулировать путем изменения концентрации, некоторые реакции, например ионные, вообще не поддаются прямому измерению с помощью струйных методов. Для того чтобы заполнить этот пробел в химической кинетике быстрых реакций, Эйген и его сотрудники разработали релаксационные методы, с помощью которых можно проводить кинетические измерения в промежутки времени порядка микросекунд. [27]
На КРЭ был достигнут максимальный катодный потенциал - 0 835 В относительно стационарного ртутного электрода. По-видимому, лимитирующая реакция включает разряд ионов водорода. Анодная реакция на стационарном ртутном электроде приводит к образованию нерастворимого метансульфоната одновалентной ртути. [28]
Предельное значение катодного потенциала в уксусной кислоте составляет около - 1 7 В ( отн. КЭ), а лимитирующей реакцией является выделение водорода. [29]
При пересчете относительно водного НКЭ было найдено, что предельный потенциал составляет - 1 7 В. При использовании трудно восстанавливаемых фоновых электролитов лимитирующей реакцией будет, по-видимому, разряд ионов водорода. [30]
Страницы: 1 2 3 4